3. Keemiliste protsesside seaduspärasused
Keemiline kineetika on teadus keemiliste reaktsioonide kiirusest, kuid selleks, et ennustada, millise reaktsioonisegu lõpuks saame, peame teadma ka seda, milline on reaktsiooni tasakaal - kas lähteained reageerivad lõpuni ja annavad saadused või jääb osa lähteainetest reageerimata.
Kõik teavad vast vaidlust, kumb oli enne, kas muna või kana. Sarnast vaidlust võiks arendada ka teemal: "Kummast õppimist alustada, kas reaktsiooni kineetikast või hoopis tasakaalust?". Loomulikult peab reaktsioon enne toimuma, kui saab tekkida tasakaal, kuid tegelikult on need kaks nähtust teineteisega väga tihedalt seotud ja sellepärast vaatleme neid koos.
Siit edasi saame esitada päris mitu küsimust:
- Millest reaktsiooni kiirus sõltub?
- Miks sõltub kiirus kontsentratsioonist ja temperatuurist?
- Kuidas reaktsiooni kiirust mõõta ja arvutada?
- Kas reaktsioon saab toimuda ka teistpidi?
- Milline on reaktsiooni energiadiagramm ehk kas üle mäe või kuru või vastumäge?
- Millal saabub tasakaal?
- Kui tasakaal on saabunud, kas siis reaktsioon enam ei toimu?
- Kui reaktsioon toimub lõpuni, kas sellel reaktsioonil polegi tasakaalu?
- Kas tasakaaluolekut saab millegagi mõjutada?
Nendele ja võibolla ka mõnele muule küsimusele hakkamegi selles peatükis vastuseid otsima.
Põhimõisted
- reaktsiooni kiirus
- pöörduv reaktsioon, pöördumatu reaktsioon
- reaktsiooni aktiveerimisenergia
- reaktsiooni soojusefekt
- katalüsaator ja katalüüs
- keemiline tasakaal
3.1. Reaktsiooni kiirus ja tasakaal
Keemiline kineetika on teadus keemiliste reaktsioonide kiirusest.
Mis on keemilise reaktsiooni kiirus, millised tegurid mõjutavad reaktisooni kiirust – nendele küsimustele saad vastuse järgnevast videost.
Allikas: https://youtu.be/E0MlY2Y7MQ0
Mis on reaktsiooni kiirus?
Keemilise reaktsiooni kiirus väljendab aine kontsentratsiooni muutust ajaühikus.
Keemilise reaktsiooni kiirus väljendab aine kontsentratsiooni muutust ajaühikus. Kiirust tähistakse tähega v ning selle põhiühik on mol dm-3 s-1. Kuigi koolis kiiruse valemit ei õpetata, siis selguse mõttes toome selle siin siiski välja:
$v=\frac{c_{lõpp}-c_{alg}}{t_{lõpp}-t_{alg}}=\frac{\Delta c}{\Delta t}$
clõpp ja calg on aine lõpp- ja algkontsentratsioonid (ühik mol/dm3 ehk M), talg ja tlõpp tähistavad ajavahemikku, mille vältel protsessi vaadeldakse (aja ühik võib olla sekund, aga kasutatakse ka minutit, tundi ja mõnikord koguni aastat).
Kui kiiresti reaktsioon toimub?
Kindlasti tead juba, et reaktsioonid võivad toimuda väga erineva kiirusega. Näiteks happe ja leelise kokkusegamisel toimub reaktsioon kiiresti (keeduklaas läheb kiiresti kuumaks). Mõned protsessid toimuvad aga väga aeglaselt, nii aeglaselt, et me ei jõuagi seda ära oodata. Üheks selliseks näiteks on teemandi lagunemine grafiidiks: vanaema teemantsõrmusest võib saada lõpuks tükike grafiiti, aga me ei jõua kunagi seda hetke ära oodata.

Joonis 1. Teemant ja grafiit. Allikas: https://www.petragems.com/blog/difference-between-diamond-and-graphite/
Millest reaktsiooni kiirus sõltub ehk teeme "elevandile hambapastat"
 Vaata "elevandi hambapasta" katset.
Vaata "elevandi hambapasta" katset.
Oled vast näinud katset "elevandi hambapasta". Selle reaktsiooni võrrand on tegelikult lihtne:
2H2O2 → 2H2O + O2
Kui valada vesinikperoksiidi lahus mensuuri, siis on raske seal näha mingeid muutusi. Vesinikperoksiid küll laguneb valguse toimel (sellepärast säilitatakse seda tumedas pudelis), kuid see reaktsioon on väga aeglane.
Kui aga lisada vesinikperoksiidi lahusele kaaliumjodiidi lahust, siis võib saada päris tormilise reaktsiooni, mis toimub kahes etapis:
H2O2 + I- → OI- + H2O
H2O2 + OI- → I- + H2O + O2
Märkus: Need etapid on toodud illustratsiooniks, sedasorti väga kiiresti edasi reageerivate vaheühenditega ioonreaktsioonid ei ole gümnaasiumi keemia õppekavas.
Neid kahte võrrandit kokku nimetatakse reaktsiooni mehhanismiks. Reaktsiooni mehhanism peab alati andma kokku summaarse reaktsiooni. Proovi, kas saad mehhanismi kahest etapist kokku vesinikperoksiidi lagunemise reaktsiooni.
Selgub, et I- ja OI- on justkui ülearused, sest taanduvad võrrandist välja. Tegelikult aga mängivad nad mõlemad reaktsioonis olulist rolli: jodiidioon on katalüsaatoriks, mis tekitab vesinikperoksiidiga reageerides väga ebapüsiva reaktsioonivõimelise vaheühendi OI-, mis reageerib kiiresti edasi. Saime teada ühe võimaluse, kuidas reaktsiooni kiirust mõjutada – lasta sellel toimuda katalüsaatori toimel teist teed mööda.
Katalüsaator on aine, mis kiirendab reaktsiooni, sest võimaldab sellel toimuda teise, vähem energiat nõudva mehhanismi järgi.
Selle energia juurde tuleme hiljem tagasi. Praegu aga vaatame, kas elevandi hambapasta valmistamine õnnestub. Tegelikult mitte, sest me lihtsalt ei näe reaktsiooni toimumist. Siin aitab hädast välja nõudepesuvahend. Tekkiv hapnik koos nõudepesuvahendiga tekitab hulgaliselt vahtu, mis voolab kiirelt üle mensuuri ääre ... Või ei voola.
Kui veidi katsetada, siis selgub, et mida kangemat vesinikperoksiidi lahust kasutame, seda kiiremini ja rohkem vahtu tekib ehk seda kiiremini reaktsioon toimub.
Reaktsiooni kiirus kasvab lähteainete kontsentratsiooni ja rõhu suurendamisel, kuumutamisel, segamisel, peenestamisel ja katalüsaatori osalemisel.
Gaaside puhul tähendab suurem kontsentratsioon kõrgemat rõhku, seega rõhu suurenedes toimub reaktsioon kiiremini.
Kui reaktsioonisegu soojendada, saaksime samuti kiirema reaktsiooni. Reaktsioon toimub seda kiiremini, mida kõrgem on temperatuur.
Reaktsiooni kiirust mõjutavad veel ainete segamine ja lähteainete peenestamine. Ainete segamisel jagunevad osakesed reaktsioonisegus ühtlasemalt, osakeste põrkumine toimub seetõttu sagedamini ja reaktsiooni kiirus kasvab. Ainete peenestamine on eriti oluline tahkete ainete korral. Peenestamisel ainete kokkupuutepind suureneb, reaktsioon saab toimuda ühtlasemalt ja kiiremini.
Kokkuvõte teguritest, mis mõjutavad reaktsiooni kiirust:
- Reaktsiooni kiirus kasvab lähteainete kontsentratsiooni suurendamisel.
- Gaasiliste ainete korral rõhu suurendamisel reaktsiooni kiirus suureneb.
- Reaktsioon toimub seda kiiremini, mida kõrgem on temperatuur.
- Reaktsiooni kiirust mõjutavad veel ainete segamine ja lähteainete peenestamine.
- Katalüsaatori juuresolekul reaktsiooni kiirus suureneb.
3.2. Reaktsiooni energiadiagramm ja aktivatsioonienergia
Miks sõltub kiirus kontsentratsioonist ja temperatuurist?
Reaktsioon toimub seda kiiremini, mida suurem on reageerivate ainete kontsentratsioon ja mida kõrgem on osakeste energia ehk mida rohkem on aktiivseid põrkeid.
Vaatame vesiniku reaktsiooni gaasilise joodiga (temperatuur peab olema nii kõrge, et jood oleks gaasilises olekus):
H2 + I2 → 2 HI
Selleks, et vesiniku- ja joodimolekul reageeriksid, peavad nad sattuma lähestikku ehk kokku põrkama. Mida tihedamalt osakesed paiknevad, seda rohkem on vesiniku- ja joodimolekulide vahelisi põrkeid ja seda kiirem on ka reaktsioon.
Tegelikult ei piisa vaid sellest, kui nad nagu pallid kokku põrkavad ja siis uuesti eemale lendavad. Nad peaksid nii kaua koos liikuma, et vanad sidemed jõuaksid katkeda ja uued tekkida.
Temperatuur suurendab kõigi reaktsioonide kiirust.
Selleks, et ühendis vanad sidemed katkeksid, on vaja energiat. Järelikult võivad saaduse anda vaid need põrked, mille osakesed on selleks piisava energiaga, mida nimetatakse aktivatsioonienergiaks. Selliseid põrkeid nimetatakse aktiivseteks põrgeteks. Kõrgemal temperatuuril on piisava energiaga osakesi rohkem, järelikult on reaktsioon kiirem.
Kas reaktsioon saab toimuda ka teistpidi?
Lühike vastus on "nii ja naa".
Kui ampull täita toatemperatuuril N2O4-ga, mis on värvitu gaas, siis hakkab ampulli sisu värvuma pruuniks: ampulli tekib NO2. Kui aga sulgeda ampulli puhas pruuni värvusega NO2 ja jahutada ampull 0 oC-ni, siis muutub ampulli sisu heledamaks – tekib N2O4. Nii saame reaktsiooni kirja panna järgnevalt:
N2O4 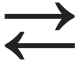 2NO2.
2NO2.
 reaktsioonivõrrandis tähendab seda, et reaktsioon võib kulgeda mõlemas suunas ehk on pöörduv.
reaktsioonivõrrandis tähendab seda, et reaktsioon võib kulgeda mõlemas suunas ehk on pöörduv.
Praktiliselt lõpuni kulgevad need reaktsioonid, milles tekib sade, gaas, vesi või muu vähedissotsieeruv ühend.
Kui segada kokku võrdsetes moolkogustes NaOH-d ja HCl-i, siis kulgeb aga reaktsioon lõpuni: saadud lahus pole ei happeline (nagu HCl) ega ka aluseline (nagu NaOH). Keeduklaasi on tekkinud NaCl neutraalne lahus ning OH- ja H+ ioonid on moodustanud kokku vähedissotsieeruva ühendi – vee. Selline reaktsioon on pöördumatu ehk kulgeb praktiliselt lõpuni:
NaOH + HCl → NaCl + H2O.
Ka põlemisreaktsioonid kulgevad lõpuni.
Praktiliselt lõpuni kulgevad need reaktsioonid, milles tekib
- sade,
- gaas,
- vesi või muu vähedissotsieeruv ühend.
Reaktsiooni energiadiagramm ehk kas üle mäe või kuru või vastumäge?
Nüüd on paras aeg vaadata eelnevalt lubatud reaktsiooni energia selgitusi. Öeldakse, et üks pilt on parem kui tuhat sõna. Võtame näiteks eelmisest alapunktist tuttava pöörduva reaktsiooni:
N2O4  2 NO2
2 NO2
mille energiadiagramm näeb välja selline:
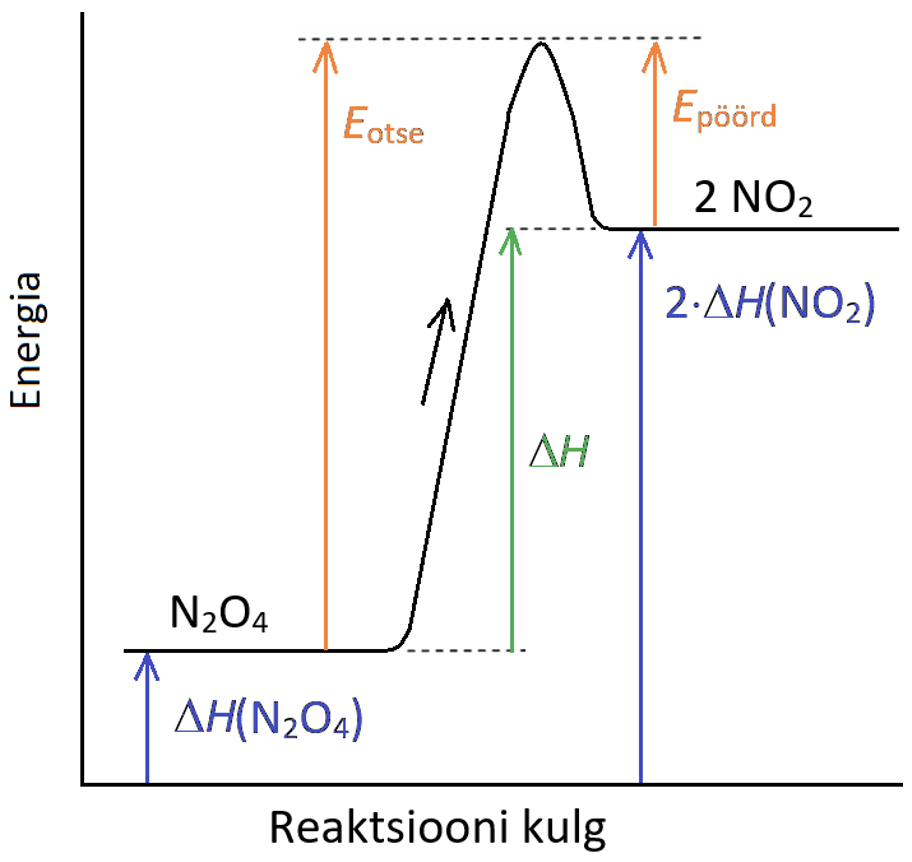
Joonis 1. Energiadiagramm
Graafikul on musta joonega märgitud energiamuutused reaktsiooni käigus puhtast lähteainest (N2O4) kuni puhta saaduseni (NO2). Must nool näiteab otsereaktsiooni suunda. Värviliste nooltega on märgitud rida energiaid, mida vaatame kohe lähemalt.
Nagu eespool nägime, peab selleks, et reaktsioon (antud näites ühe N2O4 molekuli lagunemine) toimuks, olema reageerivatel osakestel piisavalt energiat. Otsereaktsioonis on vastav minimaalne vajalik energia Eotse, pöördreaktsioonis 2NO2  N2O4 aga Epöörd.
N2O4 aga Epöörd.
Skeemil toodud reaktsiooni lähteainete energia on palju väiksem kui saaduste energia (sinised nooled), st saaduste saamiseks tuleb lähteainetele energiat juurde anda. Seda energiat, mida tuleb lisada või mis reaktsioonis vabaneb, nimetatakse reaktsiooni soojusefektiks ΔH.
 Ekso- ja endotermiliste reaktsioonide kohta loe siit.
Ekso- ja endotermiliste reaktsioonide kohta loe siit.
Reaktsiooni soojusefekti ΔH saame, kui lahutame saaduste ΔH väärtusest lähteainete ΔH väärtuse:
ΔH = ΔH (saadused) - ΔH (lähteained)
Kui reaktsiooni soojusefekt on positiivne, siis see reaktsioon tarbib soojust – see on endotermiline reaktsioon. Lagunemisreaktsioonid on enamasti endotermilised reaktsioonid, sest sidemete lõhkumine vajab energiat. Kui aga reaktsiooni soojusefekt on negatiivne, siis reaktsiooni käigus soojus vabaneb. Selline reaktsioon on eksotermiline reaktsioon.
Kas üle mäe või kuru või vastumäge?
Jooniselt on näha, et üle aktivatsioonienergia barjääri võib liikuda mõlemas suunas, aga loomulikult tekib küsimus, miks üle mäe, äkki saaks ka kõrvalt minna. Konkreetse reaktsioonimehhanismi jaoks on aktivatsioonienergia vähim vajalik energia, et osakeste vahel reaktsiooni elementaarakt toimuks. See on nagu kuru mäeahelikus: kõrgemalt võib, kui on jaksu, aga madalamat teed ei ole. Iseasi, kui kaevata läbi mäe tunnel, sel juhul on aktivatsioonienergia madalam, aga see on juba teine, katalüütiline mehhanism. Lisaks katalüsaatoritele võivad reaktsiooni kiirust mõjutada veel ka inhibiitorid – need aeglustavad reaktsiooni, aga nad ei tõsta aktivatsioonienergia barjääri (siis toimuks ju reaktsioon ikka tavateed mööda edasi), vaid seovad reaktsioonivõimelisi osakesi või blokeerivad reaktsioonitsentreid – kindlaid struktuuriosi, kus reaktsiooni elementaarakt toimub.
3.3. Keemiline tasakaal ja selle nihkumine
Millal saabub tasakaal?
Eelmises osas nägime, et pöörduvad reaktsioonid võivad kulgeda mõlemas suunas. Võtame seekord vaatluse alla ühe hüpoteetilise reaktsiooni A+B  C+D.
C+D.
Kui lähteained A ja B segada, siis hakkab reaktsioon toimuma kiirusega votse. Koolis sa reaktsiooni kiiruse võrrandit ei õpi, aga selguse mõttes toome selle siin ära. Reaktsiooni kiirust saab arvutada järgmise võrrandi abil:
votse = kotse × [A] × [B]
kus [A] ja [B] on lähteainete kontsentratsioonid ja kotse on otsereaktsiooni kiiruskonstant. Kuna lähteainete kontsentratsioonid reaktsiooni käigus vähenevad, siis peab järelikult vähenema ka otsereaktsiooni kiirus.
Reaktsioon on tasakaaluolekus siis, kui otse- ja pöördreaktsiooni kiirused on võrdsed.
votse = vpöörd
Kuna saadusi tekib järjest juurde, siis hakkab toimuma ka pöördreaktsioon kiirusega vpöörd. Pöördreaktsiooni kiiruse saame avaldada:
vpöörd = kpöörd × [C] × [D]
Pöördreaktsioon on alguses aeglane, sest saadusi on vähe, kuid aja jooksul pöördreaktsiooni kiirus järjest kasvab, kuni saab võrdseks otsereaktsiooni kiirusega:
votse = vpöörd
ning reaktsioon on saavutanud tasakaaluoleku.
Kui tasakaal on saabunud, kas siis reaktsioon enam ei toimu?
Kui tasakaaluolek on saabunud, siis lähteainete ja saaduste kontsentratsioonid enam ei muutu. Äsja kirjutasime võrduse juhuks, kui otse- ja pöördreaktsiooni kiirused on võrdsed. Kuna need kiirused kumbki ei ole nullid, siis peavad reaktsioonid mõlemas suunas edasi toimuma. Sellist nähtust nimetatakse dünaamiliseks tasakaaluks.
Kas tasakaaluolekut saab millegagi mõjutada?
Nüüd vaatame, kuidas reaktsiooni tasakaalu mõjutada, näiteks saada tasakaalulisest reaktsioonist rohkem saadusi.
Allikas: https://youtu.be/RqpanAUUDNw
Kontsentratsiooni mõju
Kui lisada lähteaineid, siis nihkub tasakaal saaduste suunas, sest tasakaalukonstant ei muutu.
Vaatame üldist reaktsiooni A+B  C+D.
C+D.
Kui tasakaalulisele süsteemile lisada ühte (või mõlemat) lähteainet (A-d ja või B-d), siis otsesuunalise reaktsiooni kiirus kasvab ning süsteem ei ole enam tasakaaluolekus. Reaktsiooni käigus hakkavad [A] ja [B] vähenema ja [C] ning [D] suurenema: reaktsioon toimub pärisuunas edasi, kuni saabub taas tasakaal ehk otse ja pöördprotsessi kiirused võrdsustuvad.
Rõhu mõju
Kui rõhku suurendada, siis nihkub reaktsioon selles suunas, kus on vähem gaasimolekule.
Rõhu muutus mõjutab selliseid reaktsioone, milles gaasi moolide arv muutub. Kui reaktsioonisegu N2O4  2NO2 rõhku suurendada, siis nihkub tasakaal N2O4 tekke suunas, mille tulemusena hakkab gaasisegu rõhk vähenema, sest reaktsioonivõrrandi vasakul pool on vähem gaasimolekule.
2NO2 rõhku suurendada, siis nihkub tasakaal N2O4 tekke suunas, mille tulemusena hakkab gaasisegu rõhk vähenema, sest reaktsioonivõrrandi vasakul pool on vähem gaasimolekule.
Temperatuuri mõju
Temperatuuri mõju hindamiseks vaata allolevat joonist ja püüa selgitada, kas reaktsioon N2O4  2NO2 on endo- või eksotermiline? Vasakul on ampull gaasiseguga paigutatud jäässe, keskel on jää ja vee segus (st null kraadi juures) ja paremal on ampull toatemperatuuril.
2NO2 on endo- või eksotermiline? Vasakul on ampull gaasiseguga paigutatud jäässe, keskel on jää ja vee segus (st null kraadi juures) ja paremal on ampull toatemperatuuril.
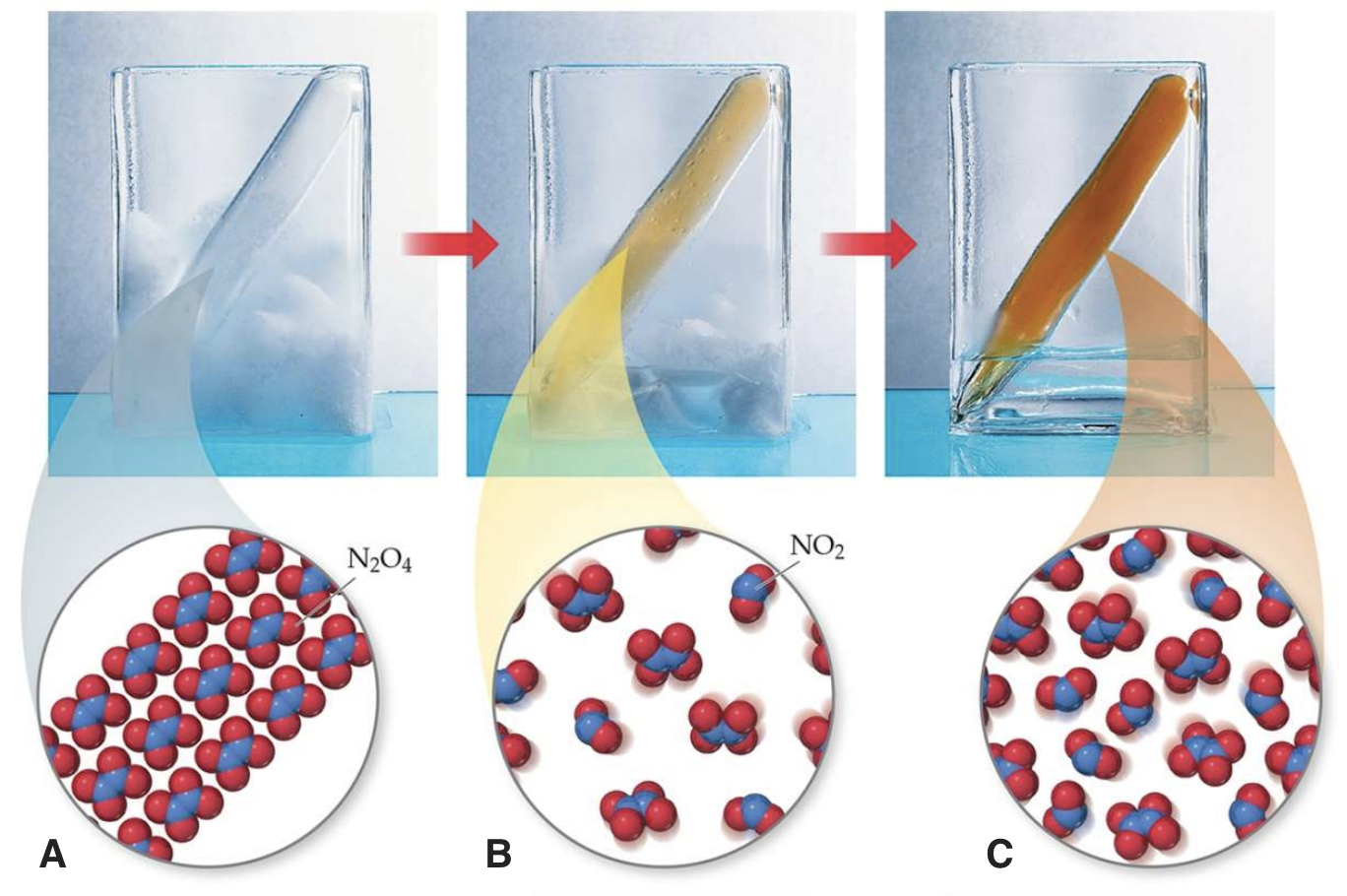
Joonis 1. N2O4 ⇄ 2NO2 reaktsioon erinevatel temperatuuridel. A) reaktsioonisegu on asetatud jäässe, B) reaktsioonisegu on 0 oC juures, C) reaktsioonisegu on toatemperatuuril. Allikas: https://www.unf.edu/~michael.lufaso/chem2046/2046chapter15.pdf
Endotermilise reaktsiooni tasakaalukonstant suureneb, kui temperatuuri tõsta.
Kui temperatuuri tõsta, siis reaktsiooni tasakaal nihkub paremale ehk saaduste suunas. Järelikult on see reaktsioon endotermiline.
Võib-olla on temperatuuri mõjust kergem aru saada, kui reaktsioon kirjutada tavapärasest veidi erinevalt, arvestades, et endotermiline reaktsioon tarbib soojust:
N2O4 + soojus  2NO2
2NO2
Le Chatelier' printsiip: kui mingi välismõju (temperatuuri, kontsentratsiooni või rõhu muutmine) rikub keemilist tasakaalu, siis kulgeb selle mõju tagajärgi vähendav reaktsioon, mis viib süsteemi üle uude tasakaaluolekusse.
Kui temperatuuri tõstame, siis lisame reaktsioonisegusse soojust juurde ja endotermiline reaktsioon nihkub saaduse suunas ehk NO2 tekke suunas.
Tavaliselt lisatakse vajadusel viide soojusefektile selliselt:
N2O4  2NO2 ΔH > 0
2NO2 ΔH > 0
Eksotermilises reaktsioonis soojus eraldub (soojus on saaduste hulgas). Kui tõsta temperatuuri, siis nihkub tasakaal lähteaine tekke suunas.
Kõik need nähtused võtab kokku Le Chatelier' printsiip: Kui mingi välismõju (temperatuuri, kontsentratsiooni või rõhu muutmine) rikub keemilist tasakaalu, siis kulgeb selle mõju tagajärgi vähendav reaktsioon, mis viib süsteemi üle uude tasakaaluolekusse.
Kas katalüsaator mõjutab tasakaalu?
Katalüsaator kiirendab reaktsiooni, kuid ei muuda reaktsiooni tasakaaluolekut.
Katalüsaatori manulusel toimub reaktsioon sellist teed pidi, kus reaktsiooni aktivatsioonienergia on madalam. Reaktsioon saavutab tasakaaluoleku kiiremini, kuid alaneb nii otse- kui ka pöördreaktsiooni aktivatsioonienergia barjäär ning tasakaal ei muutu.
3.4. Lahused ja lahustumise soojusefektid
Ainete lahustumise käigus tekib lahus või kolloidne süsteem.
Kui segad vette söögisoola või suhkrut, siis saad mõlemal juhul ühtlase läbipaistva vedeliku. Ütleme, et sool ja suhkur lahustuvad vees ehk moodustavad veega lahuse.
Lahus on ühtlane segu, mis koosneb vähemalt kahest ainest: lahustuvast ainest ja lahustist. Lahusti on aine, mis on lahuses liias ehk ülehulgas. Toodud näidetes on vesi lahustiks, sool ja suhkur aga lahustunud ained. Lahustunud aine on lahustis jaotunud üliväikeste osakeste – aatomite, molekulide või ioonidena.
 Lahustest ja pihustest saad lisaks lugeda ja vaadata siit.
Lahustest ja pihustest saad lisaks lugeda ja vaadata siit.
Merevesi on lahus, milles lahustunud aineteks on erinevad soolad (NaCl, NaI, KBr jne) ja lahustiks vesi.
Kolloidne süsteem koosneb samuti kahest või enamast ainest, aga ei ole ühtlane segu. Kolloidses süsteemis on üks aine teise sees mikroskoopiliste tilkade või tükkidena pihustunud. Näiteks piim, mis tundub ühtlane, on tegelikult kolloidne lahus, kus vees on pihustunud väikesed rasvatilgad.
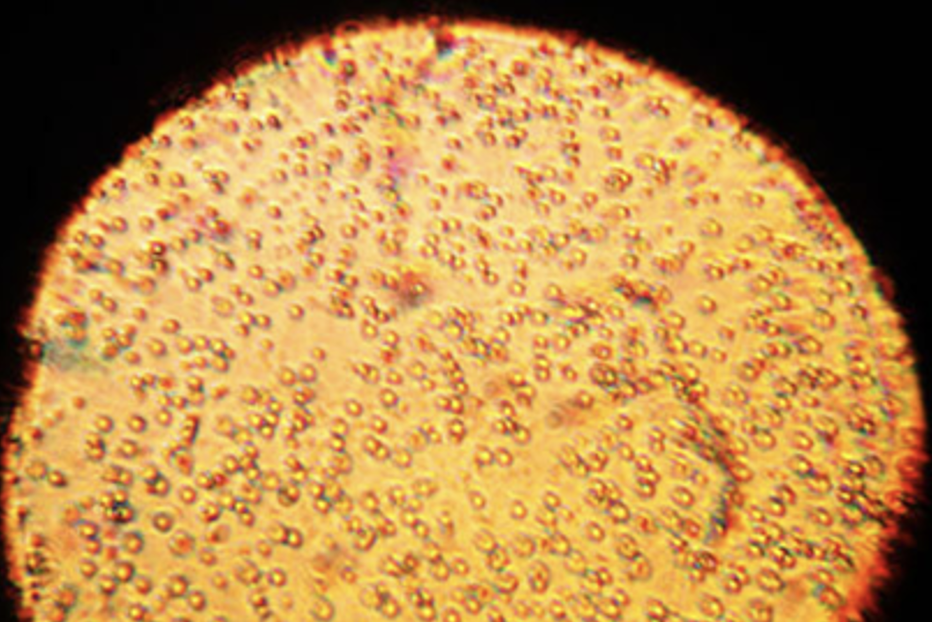
Joonis 1. Kui vaadata piima mikroskoobi all, on võimalik näha väikeseid rasvatilku. Allikas: https://goodscience.com.au/wp-content/uploads/2018/02/milk-under-microscope.jpg
Lahustumisel kehtib põhimõte, et sarnane lahustub sarnases.
Lahustumisel kehtib põhimõte, et sarnane lahustub sarnases. Vesi on polaarne lahusti, seega lahustuvad vees hästi polaarsed ained (etanool) ja/või ioonsed ained (happed, alused, erinevad soolad, nt NaCl, KCl), mille osakesed seonduvad tugevasti vee molekulidega.
Vees lahustuvad paremini polaarsed ained ja ained, mis moodutavad H-sidemeid.
Etanooli molekulid on polaarsed, seetõttu lahustub etanool vees hästi. Lahustumist soodustab lisaks molekulide polaarsusele veel ka H-sidemete teke.
Kui võrrelda erinevate alkoholide lahustuvust, siis selgub, et mida pikemaks lähevad alkoholi süsivesinkahelad, seda halvemini lahustub alkohol vees. Näiteks oktaan-1-ool ei ole vees lahustuv. Alkoholi OH- rühma ja vee molekulide vahel tekib küll H-side, aga samas alkoholi süsivesinikahela ja vee molekulide vahel on väga nõrk vastastiktoime.
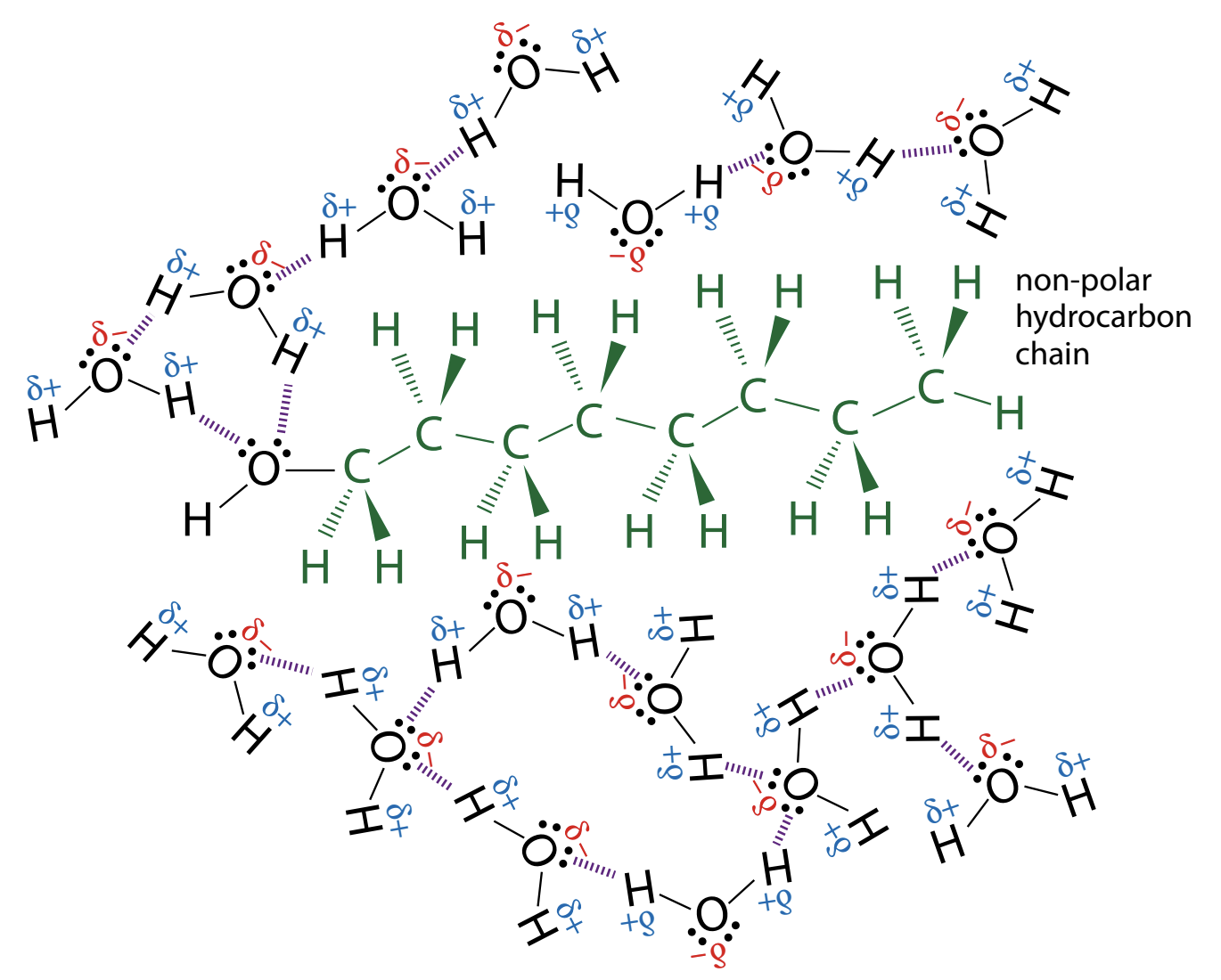
Joonis 2. Oktaan-1-ooli lahustumine vees. Jooniselt on näha, et H-sidemed tekivad ainult alkoholi OH-rühma juures. Süsivesinikahela ja vee molekulide vahel vastastiktoime on väga nõrk ja seetõttu tõrjutakse see osa veest välja. Allikas: https://bit.ly/3M8Hhi3
Mittepolaarsed ained lahustuvad paremini mittepolaarsetes lahustites.
Mittepolaarsed ained (alkaanid, rasvad jmt) lahustuvad paremini mittepolaarsetes lahustites (bensiinis, eetris). Näiteks selleks, et autolt pigiplekke puhastada, peab kasutama mittepolaarset lahustit (nt lakibensiini või spetsiaalset mittepolaarset pigiplekkide eemaldajat). Kuna pigi on mittepolaarne, siis veega puhastades pigiplekkidest lahti ei saa.
Teadmised lahustuvuse kohta on väga olulised näiteks vitamiinide manustamisel. Polaarsed vitamiinid lahustuvad kergesti ja samas väljutatakse organismist kergesti. Mitepolaarsed vitamiinid aga lahustuvad rasvades ning seetõttu ka ladestuvad rasvkoes. Seega on mittepolaarsete vitamiinide korral nende ületarbimine ohtlikum.
Kristallide lahustumine, ioonide teke lahustumisel
Tahkete ainete (nt soolade) lahustumisel kristallvõre lõhutakse ja tekivad ioonid – anioonid ja katioonid.
Ainte lahustumist saab vaadelda kahe järjestikuse etapina:
- Esialgsete sidemte katkemine. Tahkete ainete lahustumisel kristallvõre lõhutakse ja lahustuv aine läheb lahusesse kas molekulidena (näiteks suhkur) või tekivad ioonid – anioonid ja katioonid (näiteks söögisool).
- Uute sidemete teke aineosakeste ja lahusti molekulide vahel – solvatatsioon (kui lahustiks on vesi, siis nimetame seda nähtust hüdratatsiooniks).
Vaatame NaCl lahustumise näite põhjal, millised energeetilised efektid lahustumisega kaasnevad.
 Eksotermilise ja endotermilise protsessi kohta vaata täpsemalt siit.
Eksotermilise ja endotermilise protsessi kohta vaata täpsemalt siit.
- NaCl kristallvõre lagunemine: NaCl $\overset{H_{2}O}{\rightarrow}$ Na+ + Cl−.
- Kristallvõre lõhkumiseks on vaja kulutada energiat ehk tegemist on endotermilise protsessiga (ΔHkr > 0).
- Tekkinud ioonid Na+ ja Cl− hüdraatuvad. Hüdraatumine on ioonide või polaarsete molekulide seostumine lahuses vee molekulidega. Hüdraatumise protsess on kujutatud alloleval skeemil. Ühesuunaline nool tähendab, et protsess kulgeb lõpuni ja lahuses esinevad ainult ioonid. Uute sideme teke aineosakeste vahel on eksotermiline protsess ehk energiat eraldub.
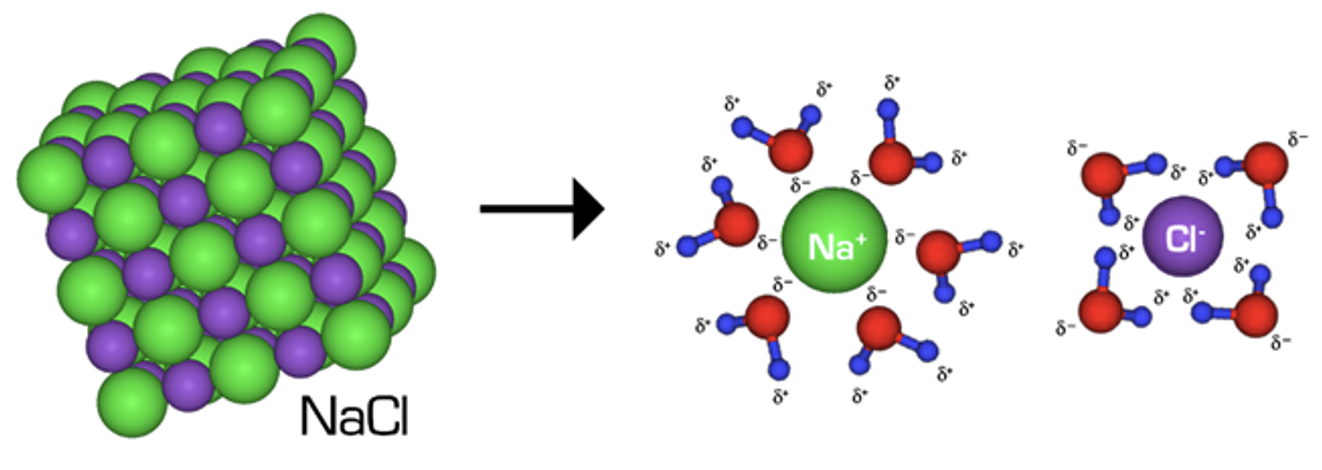
Joonis 3. Keedusoola ehk NaCl hüdraatumine, vee molekulid ümbritsevad lahustunud ioone – ioonid hüdraatuvad. Allikas: https://upload.wikimedia.org/wikipedia/commons/1/16/NaCl_dissolving.png
Kristallvõre lõhkumine on endotermiline protsess (ΔH > 0).
Uue sideme teke aineosakeste vahel on eksotermiline protsess ehk energiat eraldub (ΔH < 0).
- Kristallvõre lõhkumine on endotermiline reaktsioon.
- Hüdraatumisel tekivad uued sidemed ioonide ja vee molekulide vahel. Uute sidemete teke aineosakeste vahel on alati eksotermiline protsess ehk energiat edaldub (ΔHhüdraatumine < 0).
- NaCl lahustumise soojus on seega kahe protsessi soojuse summa: ΔHlahustumine = ΔHkr + ΔHhüdraatumine.
- NaCl lahustumine on summaarselt endotermiline protsess, sest kristallvõre lõhkumiseks kulub rohkem energiat, kui hüdraatumisel vabaneb eneriat, ΔHlahustumine > 0. NaCl lahustumise protsess on kujutatud ka alloleval energiadiagrammil.
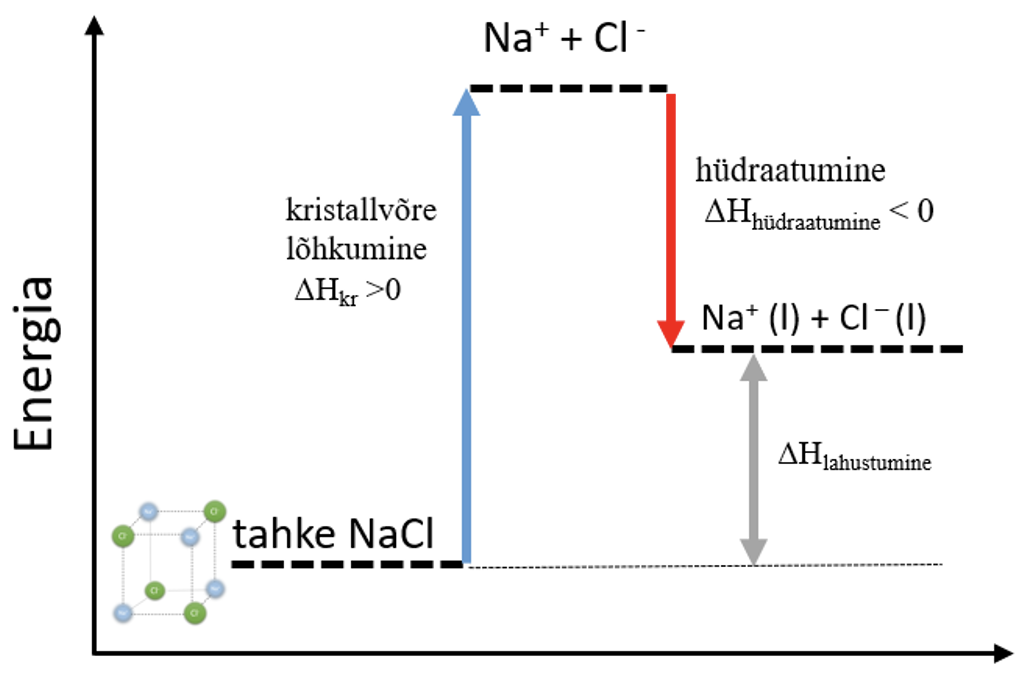
Joonis 4. NaCl lahustumine energiadiagramm
Soolade lahustumine on üldsiselt endotermiline protsess ja lahuse temperatuur langeb.
Hapete ja aluste lahustumine
Tugevate aluste ja hapete lahustumine on eksotermiline protsess ja lahus soojeneb.
Mõned leelised ja happed võivad vees väga tugevasti hüdraatuda. Eriti tugevasti hüdraatuvad ained, mis moodustavad veega vesiniksidemeid. Selliste ainete lahustumisel ületab hüdraatumine algsete sidemete katkemise energia ning protsess on tugevalt eksotermiline – ainete lahustumisel lahus soojeneb. Leeliste (NaOH, LiOH) ja hapete (HCl, H2SO4) lahustumisel tuleb olla väga ettevaatlik, sest nende lahustumisel lahus kuumeneb. Seetõttu tuleb kontsentreeritud hapet alati valada vette, mitte vastupidi. Kui lisada vett kontsentreeritud happele, siis vesi jääb esialgu kihina happe peale, sest hape on veest tihedam. Hape hakkab veekihis lahustuma ja eraldub nii palju soojust, et pealmine happeline veekiht hakkab keema. Kuum, tugevalt happeline ja seega söövitav vedelik hakkab pritsima ja see on väga ohtlik.
Vaatame NaOH vees lahustumist.
- NaOH kritallvõre lõhutakse: NaOH → Na+ + OH−.
- Kristallvõre lõhkumiseks on vaja kulutada energiat ehk tegemist on endotermilise protsessiga (ΔHkr > 0).
- Tekkinud Na+ ja OH− ioonid hüdraatuvad.
- NaOH lahustumise soojus on kahe protsessi soojuse summa: ΔHlahustumine = ΔHkr + ΔHhüdraatumine.
- NaOH (nagu ka teiste tugevate aluste ja ka hapete) lahustumine on eksotermiline protsess, sest hüdraatumise protsessi käigus eralduv energia on suurem kui kristallvõre lõhkumiseks kuluv energia.
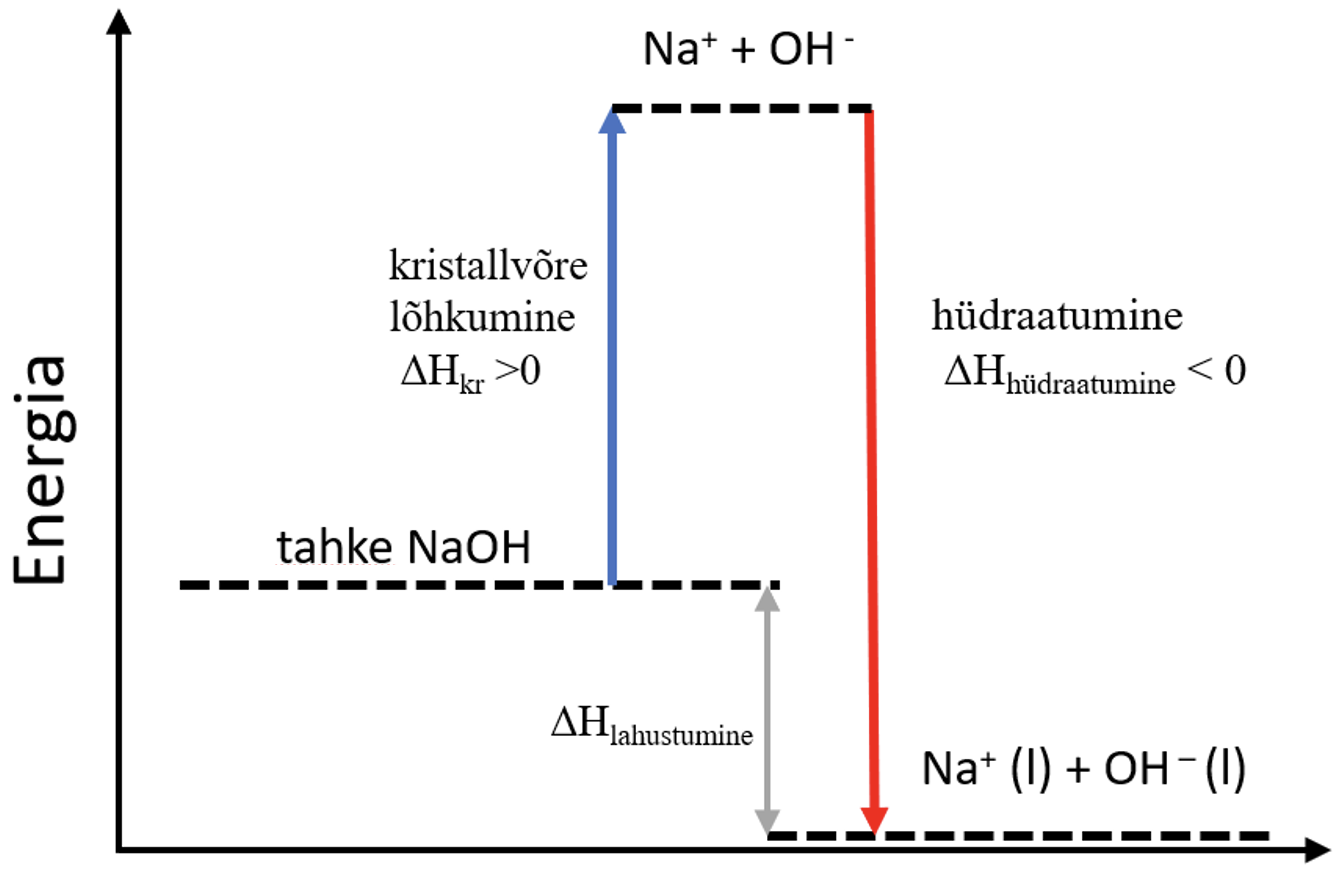
Joonis 5. NaOH lahustumine energiadiagramm
Näidisülesanded
1. Arvuta tabelis toodud andmete põhjal KI lahustumise soojusefekt:
|
KI kristallvõre lõhkumise energia |
629 kJ /mol |
|
K+ hüdraatumise energia |
-322 kJ/mol |
|
I- hüdraatumise enegia |
-293 kJ/mol |
Tabelist on näha, et KI kristallvõre lõhkumise energia on postiivne (endotermiline protsess) ja ioonide hüdraatumine on negatiivne (eksotermiline protsess). KI lahustumise soojusefekt on nende soojusefektide summa:
ΔHlahustumine = 629 kJ/mol + (-322 kJ/mol) + (-293 kJ/mol) = 14 kJ/mol, protsess on endotermiline ja lahuse temperatuur soola lahustumise käigus langeb.
2. Arvuta tabelis toodud andmete põhjal MgCl2 lahustumise soojusefekt:
|
MgCl2 kristallvõre lõhkumise energia |
2493 kJ /mol |
|
Mg2+ hüdraatumise energia |
-1920 kJ/mol |
|
Cl- hüdraatumise enegia |
-364 kJ/mol |
Magneesiumkloriidi lahustumisel tekib kloriidioone 2 korda rohkem kui magneesiumioone, sellepärast tuleb kloriidioonide hüdraatumise energia korrutada kahega.
ΔHlahustumine = 2493 kJ/mol + (-1920 kJ/mol) + 2 × (-364 kJ/mol) = -155 kJ/mol, protsess on eksotermiline ja lahuse temperatuur soola lahustumise käigus tõuseb.
Magneesium iooni laeng on 2+ ja seetõttu selle toime veega palju tugevam kui näiteks Na+ iooni korral. Magneesiumi iooni hüdraatumisel eralduv enegia on palju suurem kui Na+ või K+ iooni hüdraatumisel eralduv energia.
3.5. Lahustuvus ja lahuse kontsentratsioon
Millest sõltub ainete lahustumine vees ning kuidas teha arvutusi võttes arvesse aine lahustumist, saad vaadata järgnevast videost.
Allikas: https://youtu.be/qX48GTpOo-A
Kui lisada lahustisse järjest enam lahustuvat ainet, siis ühel hetkel aine enam ei lahustu ja sadeneb välja. Kui osa lahustatavast ainest ei lahustu, siis nimetatakse saadud lahust küllastunud lahuseks. Küllastunud lahuses on lahustunud aine kontsentratsioon maksimaalne ja rohkem ainet enam sellel temperatuuril ei lahustu.
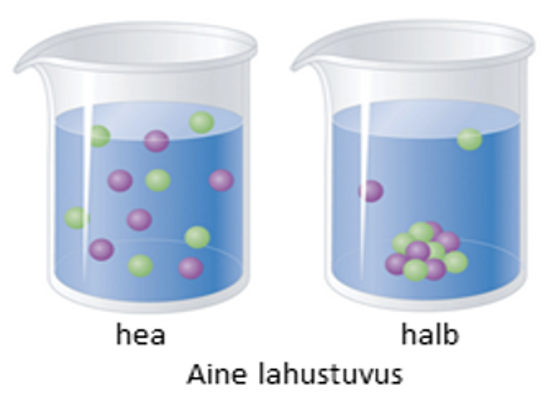
Joonis 1. Kui aine lahustub hästi ehk selle lahustuvus on suur, siis seonduvad kõik aineosakesed veega ja tahket ainet lahusesse ei jää (vasakul). Kui aine ei lahustu hästi (paremal), siis on veega seonduvaid aineosakesi vähe ja osa ainest sadeneb lahusest välja. Allikas: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/section_08/7e54d0c43e9597309aa9ecfdafbc69bb.jpg
Kui temperatuuri tõsta, siis nihkub protsessi tasakaal alati endotermilise protsessi suunas (Le Chȃtelier’ printsiip).
Enamiku soolade lahustumine on endotermiline protsess, järelikult temperatuuri tõstmisel nende lahustuvus suureneb. Mida suurem on endotermilise protsessi soojusefekt, seda rohkem mõjutab temperatuurimuutus lahustuvust.
Allolevalt graafikult on näha, et NaCl lahustuvus sõltub väga vähesel määral temperatuurist. Järelikult on NaCl lahustumise soojusefekt väga väike.
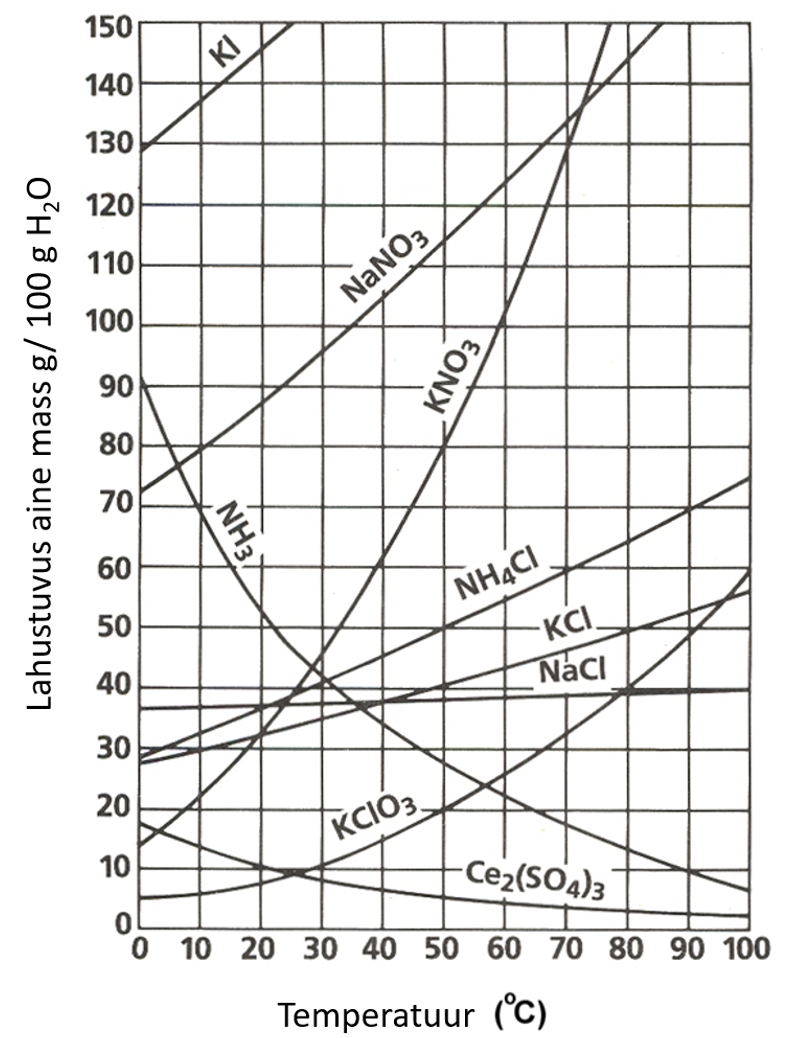
joonis 2. Soolade lahustuvuse sõltuvus temperatuurist. Allikas: 3.1 Solubility Curves - Chemistry LibreTexts
Gaaside lahustumine on eksotermiline protsess ja temperatuuri tõstes gaaside lahustumine väheneb.
Gaaside lahustumisel pole vaja esialgseid osakestevahelisi sidemeid lõhkuda, kuna gaasid koosnevad vabalt liikuvatest molekulidest. Gaaside lahustuvus on üldjuhul üsna väike ja gaasimolekulid hüdraatuvad lahustumisel vähesel määral, seega on gaaside lahustumine vähesel määral eksotemiline protsess: kui temperatuur tõsta, siis protsess nihkub gaasi eraldumise suunas.
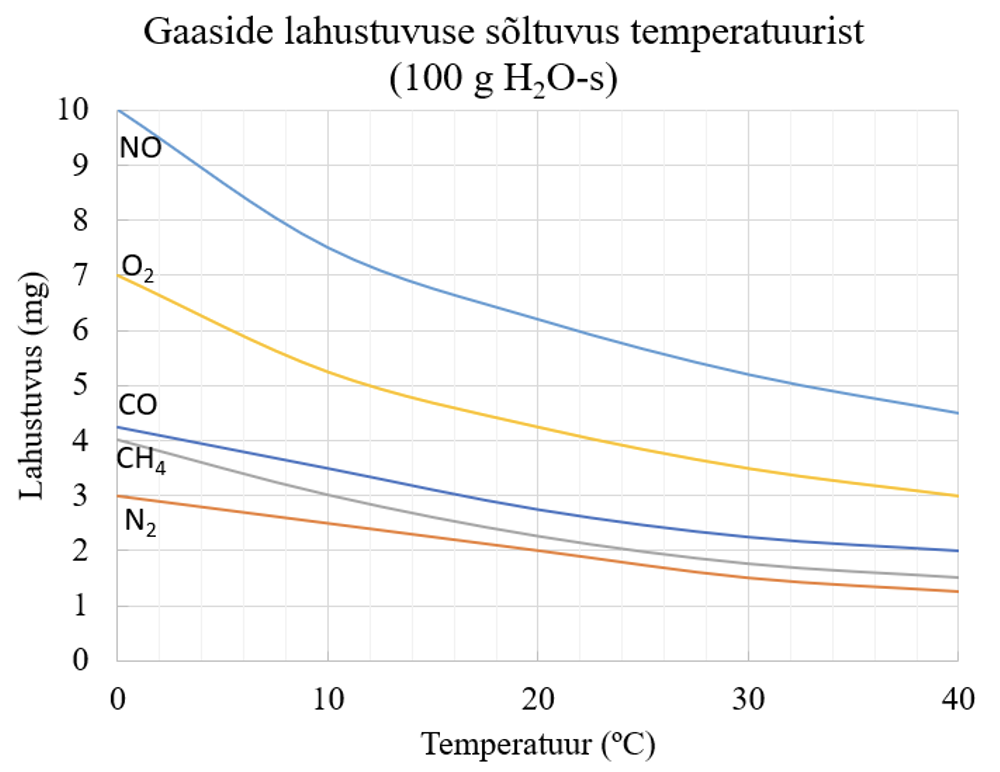
Joonis 3. Erinevate gaaside lahustuvuse sõltuvus temperatuurist
Ülesande 1 lahendused
1.4. 80 g naatriumnitraati
Vastus: 55 g
Lahendus: 70°C juures on naatriumnitraadi lahustuvus 135 g. Seega saab juurde lisada 135–80=55 g.
1.5.
Vastus: 33%
Lahendus: 80°C juures on KCl lahustuvus 50 g/100 g vees. Lahuse kogumass on seega vee mass + KCl mass ehk 100+50=150 g. KCl massiprotsent on seega:
\(P(KCl)= {50 \over 150}*100=33\)%
1.6.
Vastus: 12%
Lahendus: 80°C juures on NH4Cl lahustuvus 70 g/100 g vees. Lahuse kogumass on seega 70+100=170 g ja NH4Cl massiprotsent on 70 / 170 × 100% = 41%. 30°C juures on NH4Cl lahustuvus aga 40 g/100 g vees. Lahuse kogumass on seega 40 + 100 = 140 g ja NH4Cl massiprotsent on 40 / 140 × 100% = 29%. Seega langeb massiprotsent 41 – 29 = 12% võrra.
Lahustuvus
Lahustuvus on aine maksimaalne kogus, mida saab lahustada kindlas lahusti koguses, tavaliselt 100 g vees.
$Lahustuvus = \frac{lahustunud\ aine\ mass\ (g)}{100\ g\ lahustit\ (H_{2}O)}\times 100\%$
Näidisülesanne 1
Tuuli tegi tassi suhkrulahust, selleks võttis ta tassitäie vett ehk 200 grammi vett ja lahustas seal supilusikatäie (25 g) suhkrut.
$Lahuse\ massi\hspace{0cm}protsent = \frac{25\ g\ suhkrut}{200\ g\ vett + 25\ g\ suhkrut} \times 100\%=11\%\ suhkrulahus$
Tuuli jõi seega 11% suhkrulahust.
Kui suhkru lahustuvus puhtas vees on 20 °C juures 204 g suhkrut 100 grammi vee kohta, siis mitu grammi suhkrut peaks Tuuli veel lisama, et ta saaks küllastunud suhkrulahuse?
204 g suhkrut oleks 100g vees küllastunud lahuse korral.
m grammi suhkrut oleks 200 g vees küllastunud lahusese korral.
$m(suhkur)=\frac{200\times 204}{100}=408\ g$
Kuna klaasi oli lisatud juba 25 g suhkrut, siis juurde peaks lisama 408 g - 25g = 383 g suhkrut.
Edasise suhkruhulga lisamisel lahusesse näeksime suhkru väljasadenemist.
Ülesande 2 lahendused
2.1.
Vastus: ei ole küllastunud
Lahendus: Mari lahus koosneb 50 g glükoosist ja 200 ml veest. Glükoosi lahustuvus on 909 g ühes liitris vees, siis 200 ml ehk 0,2 liitris lahustub glükoosi 909×0,2=182 grammi. Kuna Mari lahustas vähem kui 182 grammi glükoosi 200 ml-s, ei ole lahus küllastunud.
2.2.
Vastus: 20%
Lahuse kogumass on 50 g glükoosi + 200 g vett ehk 250 grammi. Glükoosi massiprotsent:
\(P(glükoos) = {50 \over 250}*100=20\)%
2.3.
Vastus: 227 g
Kui ühes liitris vees lahustub 909 grammi glükoosi, siis 0,25 liitris lahustub 909×0,25=227 grammi.
2.4.
Vastus: 2,78%
Lahendus: Leiame lisatud soola kogumassi, see on 10×14,3=143 grammi. Vee ruumala oli 5 liitrit, seega selle mass oli tihedust 1 g/cm3=1 kg/dm3 arvestades 5 kg ehk 5000 g. Pärast soola lisamist oli soolalahuse kogumass 143+5000=5143 grammi. Soola massiprotsent selles:
\(P(sool) = {143 \over 5143}*100=2.78\)%
2.5.
Vastus: 180 g
Lahendus: Kui 1000 ml vees lahustub 360 g soola, siis 500 ml vette tuleks lisada poole vähem ehk 360/2=180 g.
Ülesande 3 lahendused
3.1. Lahendus: Kasuta valemit \(c = {n \over V}\)
3.2. Lahendus: Kasuta valemit n = c × V
3.3. Lahendus: Baariumbromiidi molekulvalem on BaBr2. Teada on V=200 ml ehk 0,2 dm3 ja c=4 M, seega on moolide arv n=4 M × 0,2 dm3 = 0,8 mol. Molekulvalemist näeme, et 0,8 moolis baariumbromiidis on sama arv moole ehk 0,8 mol baariumioone ja kaks korda rohkem bromiidioone ehk 2×0,8 = 1,6 mol.
3.4. Lahendus: Teada on baariumbromiidi V=200 ml ehk 0,2 dm3 ja c=4 M, seega on moolide arv n=4 M × 0,2 dm3 = 0,8 mol. Reaktsioonivõrrandist näeme, et BaBr2 ja H2SO4 moolsuhe on 1:1, seega on H2SO4 vaja samuti 0,8 mol. Väävelhappe lahuse kontsentratsioon c=0,4 M, seega on ruumala \(V(H_2SO_4) = {n\over c}= {0.8mol\over 0.4M}=2 liitrit\)
3.6. Mis on elektrolüüdid ja mitteelektrolüüdid?
Lahustunud ained on lahustes kas molekulide või ioonidena.
Elektrolüüt on aine, mis jaguneb lahustumisel ioonideks. Ainete jagunemine ioonideks on elektrolüütiline dissotsiatsioon. Ioonid on kas positiivselt laetud ehk katioonid või negatiivselt laetud ehk anioonid. Kuna ioonid on liikuvad laenguga osakesed, siis elektrolüütide lahused juhivad elektrit. Elektrolüüdid on soolad, happed ja alused.
Mitteelektrolüüt on aine, mis lahustumise käigus ioonideks ei jagune ja esineb seega lahuses molekulidena. Kuna mitteelektrolüütide lahustes ioone ei ole, ei juhi need elektrit. Mitteelektrolüüdid on näiteks lihtained (väävel, lämmastik, hapnik jpt) ja paljud orgaanilised ühendid (etanool, valge suhkur e sahharoos jne).
Allikas: https://youtu.be/xFc5uOP_tqU
Elektrolüüte saab liigitada elektrolüüdi tugevuse alusel.
- Tugevad elektrolüüdid esinevad lahuses ainult ioonidena (soolad, tugevad happed ja alused). Tugevate elektrolüütide lahused juhivad hästi elektrit.
- Nõrgad elektrolüüdid jagunevad lahuses ainult osaliselt ioonideks. Mida nõrgem on elektrolüüt ehk mida vähem on molekulid dissotsieerunud ioonideks, seda väiksem on ka lahuse elektrijuhtivus.
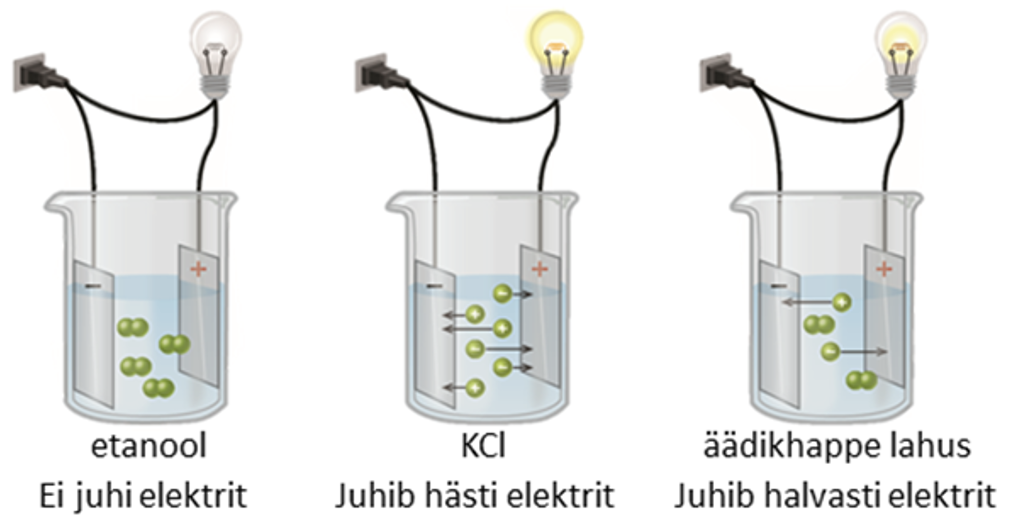
Joonis 1. Lahuste elektrijuhtivus: mitteelektrolüüdi etanooli lahus (vasakul) ei juhi elektrit, tugeva elektrolüüdi KCl lahus juhib elektrit hästi ja nõrga elektrolüüdi äädikhappe lahus juhib elektrit halvasti. Allikas: https://opentextbc.ca/chemistry/wp-content/uploads/sites/150/2016/05/CNX_Chem_11_02_electrolyt.jpg
Soolad on tugevad elektrolüüdid.
Soolad on tugevad elektrolüüdid: nad jagunevad lahustumisel täielikult ioonideks. Mõned näited erinevate soolade dissotsatsioonist:
Ca(NO3)2 $\xrightarrow[]{H_{2}O}$ Ca2+ + 2NO3-
FeSO4 $\xrightarrow[]{H_{2}O}$ Fe2+ + SO42-
K2SO4 $\xrightarrow[]{H_{2}O}$ 2K+ + SO42-
Dissotsiatsioonivõrrandite koostamisel tuleb tähele panna, et ioonide arv ja laengud oleksid õigesti määratud ning võrrand tasakaalustatud. Kuna soolade elektrolüütiline dissotsiatsioon kulgeb täielikult lõpuni (ei ole pöörduv protsess), siis kirjutatakse võrrandisse ühesuunaline nool.
Tugevad happed ning alused on tugevad elektrolüüdid. Nende elektrolüütiline dissotsiatsioon kulgeb lõpuni.
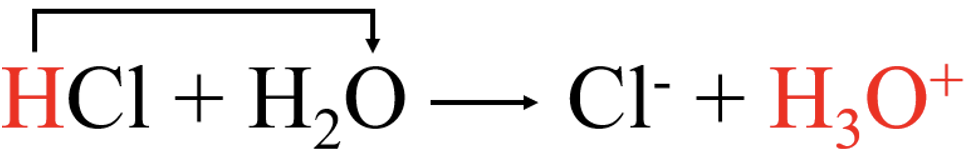
Tugevad happed ning alused on tugevad elektrolüüdid ja jagunevad lahustumisel täielikult ioonideks. Näiteks vee toimel HCl molekul laguneb ja tekib hüdrooniumioon (H3O+):
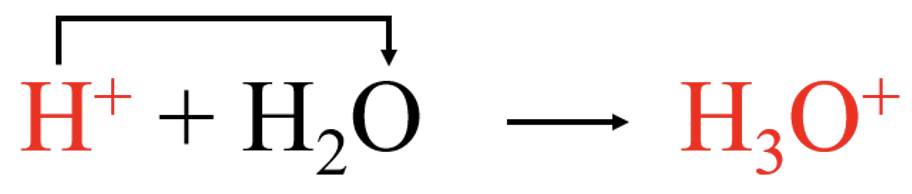
Kovalentne side HCl molekulis katkeb ja ühine elektronpaar läheb elektronegatiivsemale aatomile e kloori aatomile ning moodustub kloriidioon (Cl−):
HCl + H2O → Cl- + H3O+.
Ka teiste hapete lahustumise käigus jääb vesinik elektronpaarist n-ö ilma, seondub vee molekuliga ja tekib hüdrooniumioon.
Tugev alus naatriumhüdroksiid jaguneb lahustudes täielikult naatriumi katiooniks ja hüdroksiidaniooniks:
NaOH $\xrightarrow[]{H_{2}O}$ Na+ + OH − .
Tugevate hapete ja aluste elektrolüütiline dissotsiatsioon kulgeb lõpuni ja lahuses esinevad ainult ioonid, happe või aluse molekule lahuses ei ole.
Nõrgad happed ning alused on nõrgad elektrolüüdid.
Nõrgad happed ja alused on nõrgad elektrolüüdid ning jagunevad ehk dissotsieeruvad lahustumisel vaid osaliselt ioonideks. Nõrkade elektrolüütide dissotsiatsioon on pöörduv protsess. Pöörduvaid reaktsioone tähistatakse kahesuunalise noolega. Nõrga elektrolüüdi lahuses esineb nii aine molekule kui ka selle aine molekulidest tekkinud ioone.
Etaanhappe ehk äädikhappe dissotsiatsioon: CH3COOH + H2O ⇆ CH3COO− + H3O+.
Lämmastikushappe dissotsiatsioon: HNO2 + H2O ⇆ NO2− + H3O+ .
Ammoniaakhüdraadi dissotsiatsioon: NH3×H2O ⇆ NH4+ + OH−.
Tabel 1. Näited tugevatest ja nõrkadest elektrolüütidest
|
Tugevad elektrolüüdid Lahuses ainult ioonidena |
Nõrgad elektrolüüdid Lahuses osaliselt ioonidena |
|||
|
soolad |
tugevad happed |
leelised |
nõrgad happed |
nõrgad alused |
|
NaCl, KNO3, CuSO4, K2CO3, jpt |
H2SO4, HNO3, HClO4, HI, HBr, HCl |
NaOH, KOH, LiOH, Ca(OH)2, Ba(OH)2 |
H2SO3, HNO2, H2CO3, H2S, H3PO4, CH3COOH |
Zn(OH)2, Cu(OH)2, Al(OH)3, Fe(OH)3, NH3∙H2O |
Astmeline dissotsiatsioon, mitmeprootonilised happed
Mitmeprootonilised happed sisaldavat mitut prootonit (H2SO3, H2CO3, H3PO4). Nende dissotsiatsioon kulgeb astmeliselt, kõigepealt loovutatakse esimene prooton, siis teine jne. Vaatame astmelist dissotsiatiooni süsihappe näitel:
H2CO3 + H2O ⇆ HCO3− + H3O+ (1. aste)
HCO3- + H2O ⇆ CO32− + H3O+ (2. aste)
Teises astmes dissotsieerub väga vähe ainet ja tasakaal on suunatud lähteainete poole. Mitmeprootonilised happed moodustavad vesiniksoolasid.
Tabel 2. Happed, mis tekitavad vesiniksoolasid ning hapetele vastavad happejääkioonid
|
Hape |
-1 H+ |
-2 H+ |
-3 H+ |
|
H2CO3 |
HCO3- vesinikkarbonaatioon |
CO32- karbokatioon |
- |
|
H3PO4 |
H2PO4- divesinikfostaatioon |
HPO42- vesinikfostaatioon |
PO43- fosfaatioon |
|
H2SO3 |
HSO3- vesiniksulfitioon |
SO32- sulfitioon |
- |
Ülesande 1 lahendused
1.8.
Lahendus: Kirjutame välja magneesiumsulfaadi ja väävelhappe dissotsiatsioonivõrrandid:
MgSO4 → Mg2+ + SO42-
H2SO4 → 2H+ + SO42-
Molaarsete kontsentratsioonide arvutamiseks on vaja teada ainete moolide arvu. Väävelhappe kohta on see teada, aga magneesiumsulfaadi kohta teame vaid massi. Sellest saame leida MgSO4 moolide arvu:
M(MgSO4) = 120 g/mol
\(n(MgSO_4)= {m \over M}={10 g \over 120 g/mol}=0,083 mol\)
Leiame nüüd, kui palju erinevaid ioone lahusesse dissotsiatsioonil tekib, ja nende molaarkontsentratsioonid.
Mg2+: 0,083 mol MgSO4 dissotsiatsioonil tekib 0,083 mol Mg2+ ioone. Nende molaarne kontsentratsioon c:
\(c(Mg^{2+})= {n \over V}={0.083mol \over 1.5l}=0,0055 ≈0.06M\)
SO42-: 0,083 mol MgSO4 dissotsiatsioonil tekib 0,083 mol SO42- ioone. Lahusesse lisati ka 2 mol väävelhapet, mille dissotsiatsioonil tekib 2 mol SO42- ioone. Seega on SO42- ioone kokku 0,083+2=2,083 mol. Nende molaarne kontsentratsioon c:
\(c(SO_4^{2-})= {n \over V}={2.083mol \over 1.5l}=1.388 ≈1.39M\)
H+: 2 mol H2SO4 dissotsiatsioonil tekib 2×2=4 mol H+ ioone. Nende molaarne kontsentratsioon c:
\(c(H^{+})= {n \over V}={4mol \over 1.5l}=2.666... ≈2.67M\)
3.7. Hapete ja aluste protolüütiline teooria
Hapete ja aluste definitsioone ja teooriaid on mitmeid. Üks lihtsamaid: hape on aine, mille lahustumisel tekivad lahusesse vesinikioonid, ja alus on aine, mille lahustumisel tekivad hüdroksiidioonid.
Sellisest käsitlusest alati ei piisa, sest happed ja alused võivad esineda ka mittevesilahustes ning alused võivad olla ained, mis hüdroksiidioone ei anna. Seetõttu kirjeldab happeid-aluseid üldisemalt paremini protolüütiline teooria.
Hape on aine, mis loovutab prootoni ehk vesinikiooni (prootoni doonor).
Protolüütilise hapete-aluste käsitluse järgi on hape aine, mis loovutab prootoni ehk vesinikiooni (hape on prootoni doonor).
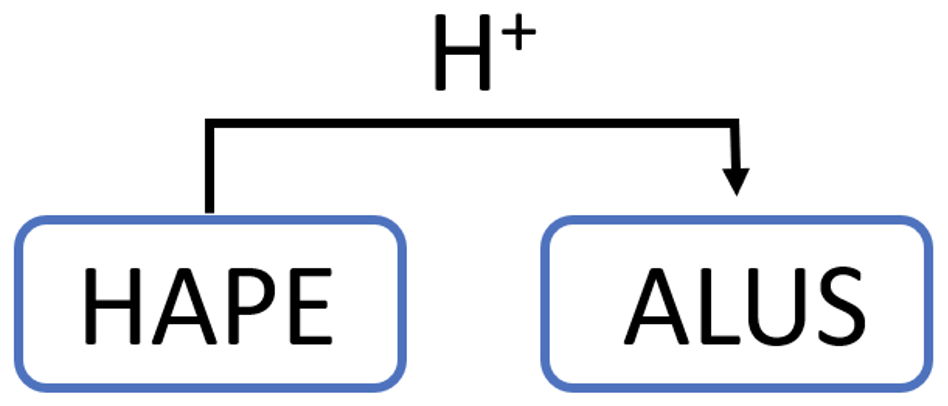
HCl käitub kui hape ja loovutab prootoni:
Selles reaktsioonis käitub vesi kui alus ehk liidab prootoni:
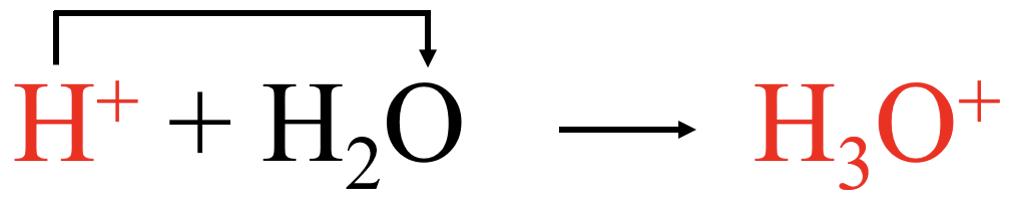
Alus on aine, mis seob prootoni (prootoni aktseptor).
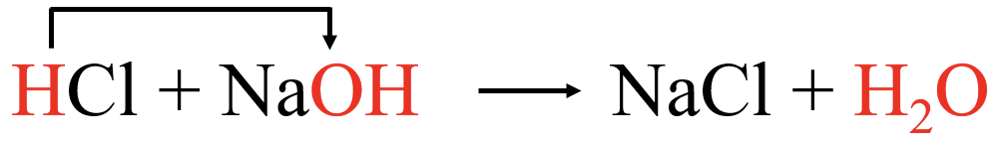
Alus on aine, mis seob prootoni (prootoni aktseptor). Happe ja aluse vahelises reaktsioonis ehk neutralisatsioonireaktsioonis loovutab hape oma prootoni alusele:
Ammoniaak käitub kui nõrk alus ja liidab prootoni:
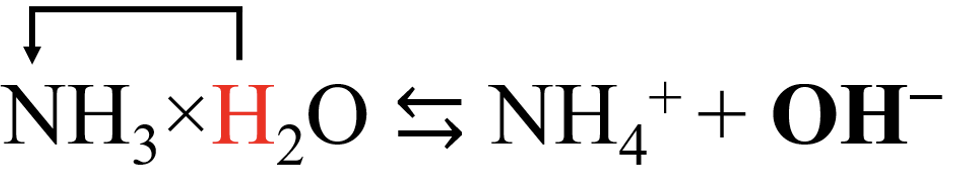
Ammoniaagi kõrval käitub vesi kui hape ja loovutab prootoni. Vaata uuesti soolhapet. Siis oli vesi hoopis aluseks. Tegelikult eksisteerivad hape ja alus protolüütilise teooria alusel alati koos: happelisemate omadustega aine on prootoni doonoriks ja vähem happeline aine seob prootoni.
Mis on lahuste happelisus ehk pH?
Lahuse happelisus/aluselisus on seotud hüdrooniumioonide (H3O+) või (lihtsamalt) vesinikioonide (H+) kontsentratsiooniga lahuses.
Allikas: https://youtu.be/YGIzUrZKzGQ
Vesi on nõrk elektrolüüt ja dissotsieerub väga vähe:
H2O ⇆ H+ + OH-
Veest tekib võrdne hulk H+ ja OH- ioone, nad neutraliseerivad teineteist ja sellepärast on puhas vesi neutraalne. H+ ja OH- ioonide kontsentratsioonon vees on võrdne ja ligikaudu 10-7 M.
Lahuse happelisust väljendatakse vesinikeksponendi ehk pH-na.
Neutraalse lahuse pH = 7.
Happelise lahuse pH < 7.
Aluselise lahuse pH > 7.
Lahuse happelisust väljendatakse vesinikeksponendi ehk pH-na.
Neutraalsete lahuste pH = 7 ja vesinikioonide molaarne kontsentratsioon cH+ = 10-7 M .
Happelistes lahustes pH on väiksem 7-st (pH < 7) ja vesinikioonide kontsentratsioon on cH+ > 10-7 M ja hüdroksiidioonide kontsentratsioon on väiksem kui 10-7 M. Mida happelisem on lahus, seda madalam on lahuse pH väärtus. pH-skaalas vastab väärtus pH = 0 väga tugevale happele, mille vesinikioonide kontsentratsioon lahuses on cH+= 1 M.
Aluselistes lahustes pH on suurem 7-st (pH > 7) ja vesinikioonide kontsentratsioon on cH+ < 10-7 M ning seega hüdroksiidioonide kontsentratsioon on cH+ > 10-7. Seega aluselises lahuses on OH- ioone rohkem kui H+ ioone. Mida aluselisem on lahus, seda suurem on lahuse pH väärtus. pH väärtus 14 vastab väga tugevale alusele, milles vesinikioonide kontsentratsioon on üliväike: cH+ = 10−14 M.
Keemiaõpikus on pH-d seletatud kui vesinikioonide kontsentratsioonis arvu 10 astendajat miinusmärgita. Siin on aga paras aeg tuua pH arvutamise valem, sest oskad juba logaritmi kasutada – võtad arvutis lihtsalt kontsentratsiooni väärtusest logaritmi (loomulikul arvestades ka 10 astmeid) ja muudad saadud vastuses märgi ära.
Niisiis, vesinikeksponent on võrdne vesinikioonide kontsentratsiooni (cH+) negatiivse logaritmiga:
pH = -log cH+
Näiteks neutraalse lahuse pH = -log (1×10-7) = 7
Analoogselt saab defineerida ka hüdroksiideksponendi:
pOH = −log cOH−
pH ja pOH on vesilahustes teineteisega seotud: pH + pOH = 14. Seda võrrandit saab vastastikusteks üleminekuteks kasutada.
Ole aga nende valemite kasutamisel tähelepanelik. Soolhape on tugevam hape kui vesi ja ei ole võimalik valmistada HCl lahust mille pH oleks > 7. Samamoodi ei saa ka kuitahes lahja NaOH lahus olla happeline, sest NaOH on tugevam alus kui vesi.
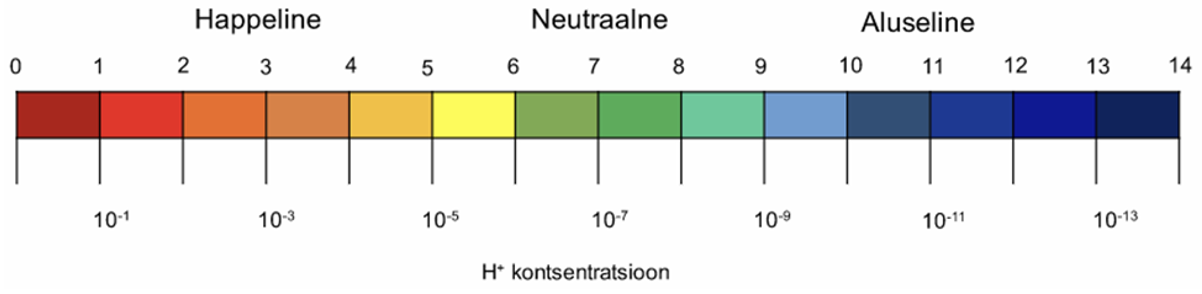
Joonis 1. pH skaala ja vesinikioonide molaarsed kontsentratsioonid. Allikas: https://e-koolikott.ee/oppematerjal/16509-Lahuse-pH
Nii tugevalt happelised kui ka tugevalt leeliselised lahused on väga söövitava toimega, sellepärast on oluline osata lahuse pH-d määrata.
Molekulaarne ja ioonvõrrand
Siiani oled kirjutanud reaktsioonivõrrandeid molekulaarsel kujul, kus lähteained ja saadused on esitatud molekulvalemitena. Näiteks hape reageerib alusega ning tekib sool ja vesi.
NaOH + HCl → NaCl + H2O molekulaarne võrrand
Soolad ja tugevad alused on aga ioonsed ained. Ioonsed ained on ained, milles osakesi (ioone) seovad ioonilised sidemed. Tahke iooniline aine koosneb seega ioonidest: katioonidet ja anioonidest. Katioon on positiivse ning anioon negatiivse laenguga osake. Ioonide vahelisi reaktsioone saame esitada ioonvõrrandina. Ioonidevahelised reaktsioonid saavad toimuda ioonide kontsentratsiooni vähenemise suunas, kui
- tekib sade,
- eraldub gaas,
- tekib vesi või mõni muu nõrk elektrolüüt.
Allikas: https://www.youtube.com/watch?v=lvkLPwbV5iM&list=PLDq4dTA-nGpj7MuhXrHsurq6XQR1gUamV&index=4
Vaatame kolme näidet ioonvõrrandite kirjutamise kohta.
1. näide. Ioonidevahelisel reaktsioonil tekib sade
Molekulaarne võrrand:
2 NaOH + CuSO4 → Cu(OH)2 + Na2SO4
Reaktsiooni tulemusena tekib rasklahustuv hüdroksiid Cu(OH)2. Täieliku ioonvõrrandi korral kirjutatakse kõik vees hästi lahustuvad ained, tugevad elektrolüüdid, ioonsel kujul. Nõrgad elektrolüüdid, gaasilised ained ja mitteelektrolüüdid kirjutatakse molekulvalemina.
Täielik ioonvõrrand:
2 Na+ + 2OH– + Cu2+ + SO42– → Cu(OH)2 + 2 Na+ + SO42–
Tumedamalt on märgitud rasklahustuv vask(II) hüdroksiid.
Tegelikult osalevad reaktsioonis ainult Cu2+ ja OH– ioonid. Lühendatud ioonvõrrandis märgi ainult need ioonid, mis võtavad reaktsioonist osa.
Lühendatud ioonvõrrand:
Cu2+ + OH– → Cu(OH)2
2. näide. Ioonidevahelisel reaktsioonil eraldub gaas
Värvusetule naatriumsulfiidi vesilahusele värvitu vesinikkloriidhape lahuse lisamisel eraldub mädamunahaisuline gaas H2S.
Molekulaarne võrrand:
Na2S + 2 HCl → H2S + 2 NaCl
Täielik ioonvõrrand:
2 Na+ + S2– + 2 H+ + 2 Cl– → H2S + 2 Na+ + 2 Cl–
Tumedamalt on märgitud gaasina eralduv divesiniksulfiid. Reaktsioonist võtavad osa ainult S2– ja H+ ioonid.
Lühendatud ioonvõrrand:
S2– + H+ → H2S
3. näide. Ioonidevahelisel reaktsioonil tekib nõrk elektrolüüt
Molekulaarne võrrand:
NaOH + HCl → NaCl + H2O
Täielik ioonvõrrand:
Na+ + OH– + H+ + Cl– → H2O + Na+ + Cl–
Tumedamalt on märgitud nõrk elektrolüüt vesi. Reaktsioonist võtavad osa ainult OH– ja H+ ioonid.
Lühendatud ioonvõrrand
OH– + H+ → H2O
3.8. Soola hüdrolüüs
Miks kõigi soolade lahused pole neutraalsed ehk mis on hüdrolüüs?
Hüdrolüüs on soola ja vee vaheline reaktsioon ning tekib vähedissotsieeruv ühend. Selle tulemusena võib muutuda lahuse pH. Hüdrolüüsuvad on soolad, mis sisaldavad nõrga happe aniooni ja/või nõrga aluse katiooni.
Allikas: https://youtu.be/ZAP1moDv2xQ
Vaatame erinevate soolade hüdrolüüsi.
Nõrga happe ja tugeva aluse soolad
Tugeva aluse ja nõrga happe soola lahus on hüdrolüüsi tõttu aluseline (pH > 7).
Nõrga happe tugeva aluse soolad on näiteks CH3COONa, NaNO3.
Vaatame lähemalt naatriumetanaadi hüdrolüüsi.
- Esmalt oleks hea vaadata, millise happe ja aluse vahelisest reaktsioonist sool on tekkinud.
- Nagu paremalt jooniselt näha, tekib naatriumetanaat etaanhappe ja naatriumhüdroksiidi vahelises neutralisatsioonireaktsioonis:
 Happe ja aluse vahelise neutralisatsiooni-reaktsiooni kohta vaata siit videost.
Happe ja aluse vahelise neutralisatsiooni-reaktsiooni kohta vaata siit videost.
CH3COOH + NaOH ⇆ CH3COONa + H2O.
- Kahesuunaline nool võrrandis tähendab seda, et see reaktsioon ei kulge päris lõpuni. Selle reaktsiooni pöördreaktsioon on soola hüdrolüüs.
- Kirjutame välja ioonvõrrandi:
CH3COOH + Na+ + OH- ⇆ CH3COO- + Na+ + H2O.

- Mõlemal pool kaksiknoolt on naatriumi ioon, mis taandub välja ning saame lühendatud ioonvõrrandi:
CH3COOH + OH- ⇆ CH3COO- + H2O.
- Kirjutame välja pöördreaktsiooni ehk soola hüdrolüüsi reaktsiooni:
CH3COO- + H2O ⇆ CH3COOH + OH-
Näeme, et lahusesse on tekkinud vabu OH- -ioone, mis muudavad lahuse keskkonna aluseliseks.
Nõrga aluse ja tugeva happe soolad
Nõrga aluse ja tugeva happe soola lahus on nõrgalt happeline (pH < 7).
Vaatame nõrga aluse tugeva happe soola hüdrolüüsi ammooniumkloriidi näitel.
- Esmalt kirjutame välja reaktsiooni, milles tulemusena antud sool tekib:
NH3H2O + HCl ⇆ NH4Cl + H2O.
- Selle reaktsiooni pöördreaktsioon on soola hüdrolüüs.
- Kirjutame välja ioonvõrrandi:
NH3 × H2O + H+ + Cl- ⇆ NH4+ + Cl- + H2O.
- Kloriidiooni saab välja taandada ning saame lühendatud ioonvõrrandi:
NH3×H2O + H+ ⇆ NH4+ + H2O.
- Kirjutame välja pöördreaktsiooni ehk soola hüdrolüüsi reaktsiooni:
NH4+ + H2O ⇆ NH3H2O + H+.
Näeme, et lahusesse tekib vesinikioone, mis muudavad lahuse keskkonna happeliseks.
Sool hüdrolüüsub seda tugevamini, mida nõrgem alus või hape hüdrolüüsil tekib. Eriti tugevasti hüdrolüüsuvad nõrga happe ja nõrga aluse soolad, kuigi nende lahuste pH ei pruugi neutraalsest erineda. Lihtsalt nii soola anioon kui ka katioon seotakse vähedissotsieeruvatesse ühenditesse.
Siiani vaatlesime vaid ühelaenguliste ioonidega soolasid. Nüüd vaatleme hüdrolüüsi seisukohalt keerukamaid süsteeme ehk astmelist hüdrolüüsi.
 Vaata ka osa "Astmeline dissotsiatsioon, mitmeprootonilised happed".
Vaata ka osa "Astmeline dissotsiatsioon, mitmeprootonilised happed".
Kui vette lisada naatriumikarbonaati Na2CO3, siis tekib nõrga süsihappe anioone:
Na2CO3 (t) → 2Na+ (l) + CO32− (l).
CO32− ioonide ja vee vahel tekib hüdrolüüsitasakaal:
CO32− + H2O ⇆ HCO3− + OH−
Tekkinud HCO3− ja vee vahel tekib samuti hüdrolüüsitasakaal:
HCO3− + H2O ⇆ H2CO3 + OH−
Mõlemas hüdrolüüsiastmes vabaneb hüdroksiidioone ja sellepärast on Na2CO3 ehk pesusooda vesilahuse pH märgatavalt kõrgem ja hüdrolüüs tugevam kui NaHCO3 ehk söögisooda ühestmelise hüdrolüüsi korral.
Nüüd oleme valmis võrdlema erinevate katioonide hüdrolüüsi:

Joonis 1. Katiooni mõju soolalahuse pH-le. Allikas: https://schoolbag.info/chemistry/central/153.html
Jooniselt on näha katiooni mõju soolalahuse pH-le. NaNO3 ei hüdrolüüsu, kaltsiumnitraat praktiliselt ei hüdrolüüsu, aga tsinknitraadi ja akumiiniumnitraadi lahused on happelised. Kõige tugevamini hüdrolüüsub Al(NO3)3. Lahustele annavad värvuse erinevad indikaatorid (vasakult paremale): bromotümoolsinine, bromotümoolsinine, metüülpunane ja metüüloranž.
Tabel 1. Hüdrolüüsunud soola lahuse pH
| Sool | Lahuse keskkond |
| Tugeva aluse katioon + tugeva happe anioon | pH ~ 7 |
| Tugeva aluse katioon + nõrga happe anioon | pH > 7 |
| Nõrga aluse katioon + tugeva happe anioon | pH < 7 |
| Nõrga aluse katioon + nõrga happe anioon | pH ~ 7 |
 Loe lisaks: Mis on puhverlahused?
Loe lisaks: Mis on puhverlahused?
Paljude reaktsioonide läbiviimiseks on vaja, et pH reaktsiooni käigus ei muutuks. Ka elusorganismide häireteta toimimiseks on vaja püsivat pH-d. Selliseid lahuseid, mille pH väikese koguse happe või aluse lisamisel ei muutu, nimetatakse puhverlahusteks.
Puhverlahus koosneb nõrgast happest või alusest ja sellele vastavast soolast.
Puhverlahusete mõju põhineb nõrga elektrolüüdi dissotsiatsioonitasakaalul. Võtame näiteks nõrga etaanhappe CH3COOH ja sellele vastava soola CH3COONa segu ja vaatame, mis muutub happe või alusel lisamisel etaanhappe dissotsiatsioonitasakaalus: CH3COOH ⇆ CH3COO- + H+
Kuna etaanhappe lahusesse lisada tema soola, siis nihkub dissotsiatsioonitasakaal vasakule (ütleme, et soola anioonid tõrjuvad happe dissotsiatsiooni tagasi). Tekib puhverlahus, kus etaanhape ja etanaatioonid on tasakaalus.
Kui nüüd lisada veidi NaOH-d, siis seotakse osa vesinikioone vees, aga selle tulemusel nihkub tasakaal paremale ehk osa etaanhappest dissotsieerub ja pH praktiliselt ei muutu.
Kui lisame puhverlahusele näiteks veidi soolhapet, siis lisanduvad vesinikioonid nihutavad tasakaalu vasakule, st vesinikioone seotakse vähedissotsieeruvasse etaanhappesse. Selle tulemusena jääb pH praktiliselt samaks.