7. Orgaanilised hapniku- ja lämmastikuühendid
Paljud orgaanilised ained sisaldavad hapnikku või lämmastikku. Järgnevalt vaatlemegi aineklasse, kus leidub hapnikku või lämmastikku sisaldav funktsionaalrühm.
7.1. Alkoholid
Alkoholi üldvalem: R–OH
Alkoholid on orgaanilised ained, milles sisaldub –OH ehk hüdroksüülrühm. Hüdroksüülrühma võib ette kujutada kui vee molekulist vesiniku eemaldamisel saadavat rühma. Igapäevaelus kasutatakse alkoholidest kõige enam etanooli (CH3CH2OH) – lahusti, kütusena ning ka alkohoolsete jookide saamiseks. Alkoholidega saad lähemalt tutvuda järgmises videos.
Allikas: https://youtu.be/gf3P84DcUVM
Alkoholide nimetamine
Alkoholide nimetamisel kasutakse järelliidet -ool. Näiteks CH3OH on metanool, CH3CH2OH etanool, CH3CH2CH2OH propanool jne. Pikema süsinikuahela puhul tuleb alkoholi korrektseks nimetamiseks arvestada ka seda, millise süsinikuaatomiga on hüdroksüülrühm seotud.
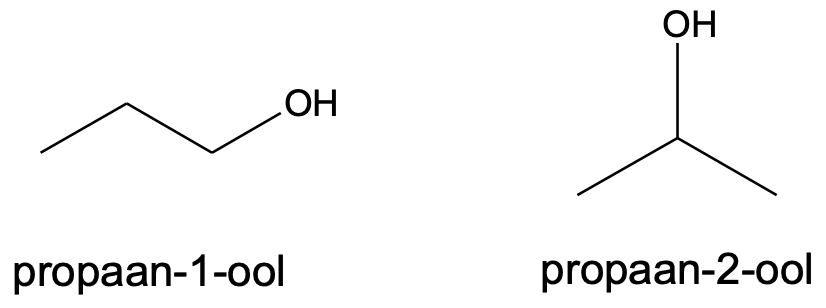
Kui hüdroksüülrühmi on rohkem kui üks, tuleb lisada nende arvu näitav eesliide.
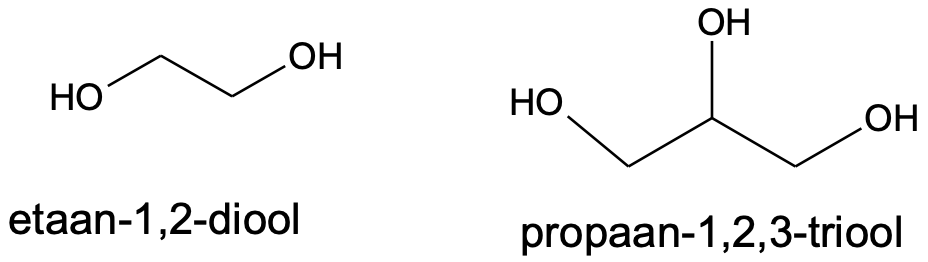
Mõnede alkoholide korral kasutatakse sageli ka mittesüstemaatilisi nimetusi, näiteks tuntakse propaan-1,2,3-triooli glütseroolina.
Alkoholide füüsikalised omadused
Alkoholid on polaarsed ja hüdrofiilsed ained, sest alkoholide molekulide vahel on vesiniksidemed.
Alkoholid on polaarsed ja hüdrofiilsed ained, sest alkoholide molekulide vahel on vesiniksidemed. Vesiniksidemed on tugevamad kui tüüpilised molekulidevahelised jõud, seetõttu on alkoholide keemistemperatuurid kõrgemad kui enamikul sarnase molekulmassiga orgaanilistel ühenditel, mille molekulide vahel vesiniksidemeid ei esine (nt süsivesinikud).
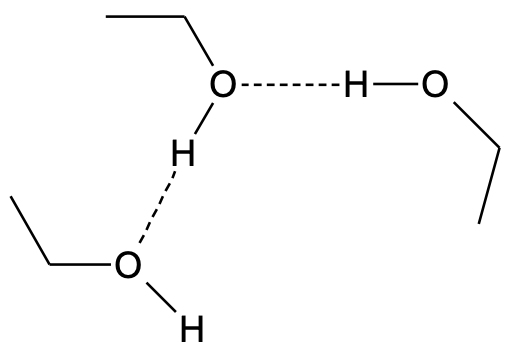
Joonis 1. Vesiniksidemed (märgitud punktiirjoonega) etanooli molekulide vahel
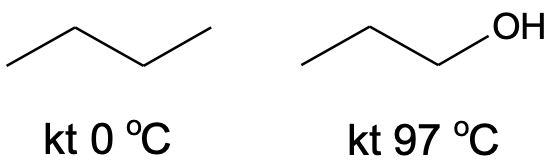
Joonis 2. Propaan-1-ooli keemistemperatuur on ligi 100 °C kõrgem kui butaani oma, ehkki nende molekulid on sarnase suurusega.
Kuna alkoholid moodustavad vesiniksidemeid ka veemolekulidega, lahustuvad lühema süsikahelaga alkoholid vees hästi. Esimesed kolm lineaarse ahelaga alkoholi segunevad veega igas vahekorras, süsinikahela pikenemisel väheneb aga ka alkoholide lahustuvus vees, sest alküülrühm on hüdrofoobne.
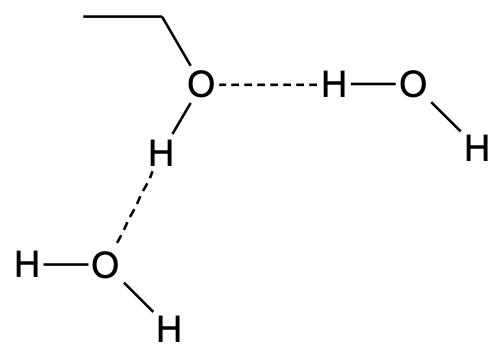
Joonis 3. Vesiniksidemed etanooli ja vee molekulide vahel
Tabel 1. Lihtsamate alkoholide keemistemperatuur ja lahustuvus vees
|
Alkohol |
CH3OH |
CH3CH2OH |
CH3(CH2)2OH |
CH3(CH2)3OH |
CH3(CH2)4OH |
|
Keemis-temperatuur, °C |
65 |
78 |
97 |
117 |
138 |
|
Lahustuvus vees, g/l |
seguneb igas vahekorras |
seguneb igas vahekorras |
seguneb igas vahekorras |
73 |
22 |
 Loe lisaks: Kuidas moodustub vesinikside?
Loe lisaks: Kuidas moodustub vesinikside?
O–H ja N–H sidemed on tugevalt polaarsed. Sidemeelektronide paari tõmmatakse tugevamini O või N aatomi juurde ning H aatomi juurde jääb elektronide puudujääk. Seetõttu on O või N aatomi juures negatiivne osalaeng (täisarvulisest laengust väiksem laeng), H aatomi juures positiivne osalaeng.

Vesiniku positiivne osalaeng tõmbab enda juurde negatiivse osalaenguga O või N aatomi elektronipaari, mille käigus moodustubki vesinikside.
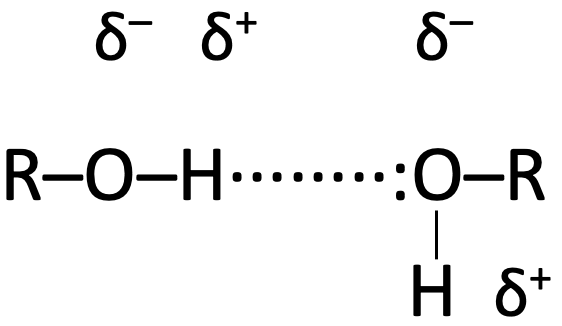
Vesinikside on tugevam kui tüüpilised molekulidevahelised jõud, kuid palju nõrgem kui kovalentne side (tüüpiline vesinikside on umbes 10 korda nõrgem kui kovalentne side).
Vesiniksidemeid moodustab ka H–F.
Alkoholide keemilised omadused
Põlemine on alkoholide täielik oksüdeerumine.
CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O
Alkoholid (metanool, etanool) põlevad kergesti ja neid saab kasutada ka kütusena, kuigi need annavad massiühiku kohta vähem energiat kui süsivesinikud. Alkoholide osalist oksüdeerumist vaatleme hiljem.
Kuigi hüdroksüülrühm võib esmapilgul meenutada hüdroksiidiooni, on alkoholide vesilahused neutraalsed. Hüdroksüülrühm võib teatud reaktsioonides, nt reageerides leelismetallidega, käituda isegi happena (nii nõrk hape, mida indikaatorid ei suuda tuvastada). Alkoholide happelised ja aluselised omadused on sarnased veele.
Alkoholide biotoime
Paljud alkoholid on mürgised. Eriti ohtlik on metanool, mille joomine võib ka väikeses koguses põhjustada pimedaks jäämist või surma. Ka etanool – alkohoolsete jookide joovastav toimeaine – on mõnevõrra mürgine. Suhteliselt mõõdukas koguses on etanool lõõgastava ja eufooriat tekitava toimega, suuremas koguses peamiselt depressant – kesknärvisüsteemi tööd aeglustav aine. Suured etanoolikogused põhjustavad uimasust, iiveldust, koordinatsiooni- ja kõneprobleeme ning mäluhäireid, väga suured kogused võivad põhjustada isegi teadvusekaotust või surma. Etanooli tarvitamine suurendab ka ohtlikesse õnnetustesse sattumise riski. Etanooli sage tarvitamine pikema ajaperioodi vältel tõstab vähki haigestumise riski, võib põhjustada sõltuvust (alkoholismi) ning kahjustada maksa ja närvisüsteemi.
7.10. Bioühendid
Bioühendid ehk biomolekulid on orgaanilised ained elusorganismides, mis osalevad elutegevusega seotud protsessides. Need ained on olulised nii organismi struktuuride ehituses kui ka elutegevuseks vajalikes ainevahetuse reaktsioonides. Elu on keemia seisukohalt väga keeruline nähtus ja organismide koostises on väga palju erinevaid orgaanilisi ja anorgaanilisi aineid. Selles peatükis käsitleme põgusalt kolme olulisemat biomolekulide klassi: rasvad, sahhariidid ja valgud.
Rasvad
Rasvad on glütserooli (propaan-1,2,3-triooli) ja rasvhapete triestrid. Rasva teket võib ette kujutada kui glütserooli molekuli ja kolme rasvhappe molekuli reaktsiooni, mille käigus moodustub kolm estersidet.
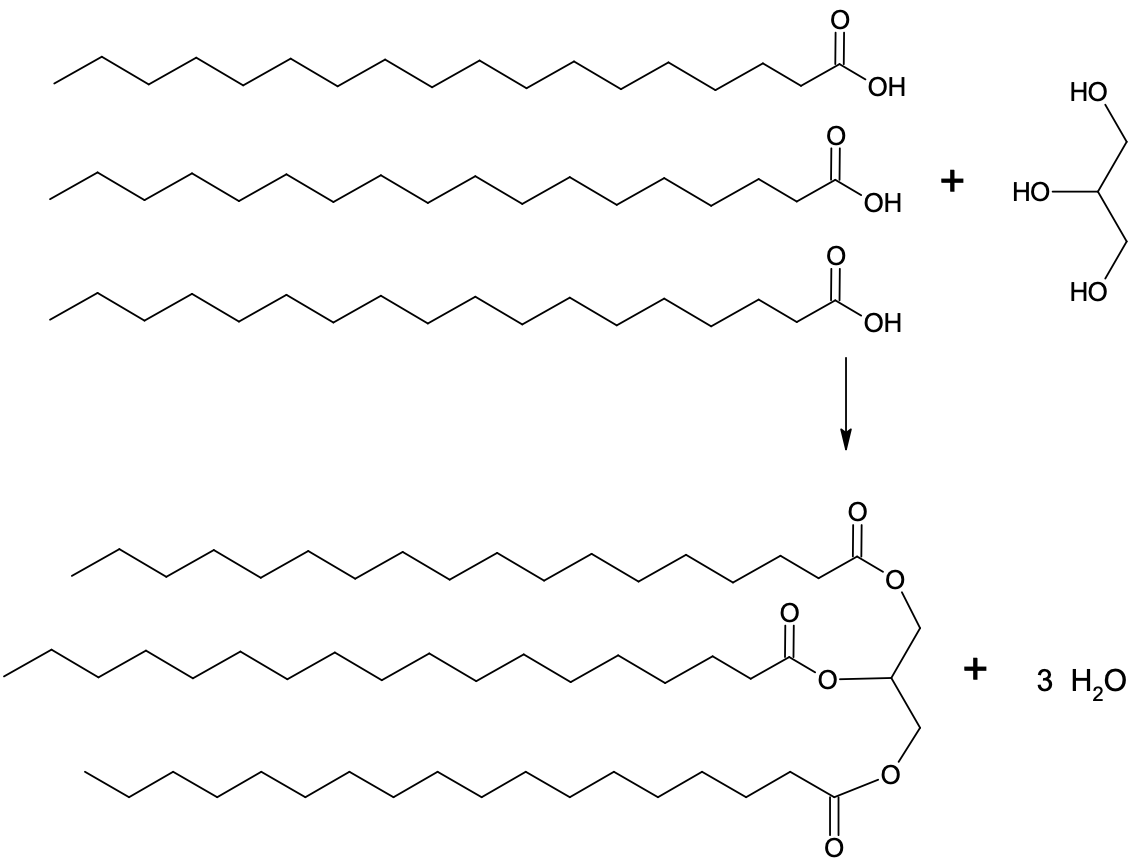
Joonis 1. Rasva teke
Kuna rasvamolekulides on pikad alküülahelad ning puuduvad tugevalt polaarsed rühmad, siis on rasvad väga hüdrofoobsed ning ei lahustu vees. Tavaliselt jaotatakse rasvu nende koostises leiduvate rasvhappejääkide järgi. Kui rasvhapetest pärinevates ahelates on kõik süsinikuaatomite vahelised sidemed üksiksidemed, siis on tegemist küllastunud rasvaga. Kui ahelates on aga üks või mitu kaksiksidet, on tegemist küllastumata rasvaga. Üldreeglina on küllastunud rasvhappeid rohkem tahketes loomsetes rasvades ja küllastumata rasvhappeid rohkem vedelates taimsetes õlides. Kuna rasvade energiasisaldus on suur, on nende peamine ülesanne olla energiarikkad varuained. Rasvad annavad võrreldes teiste toitainetega palju rohkem energiat (massiühiku kohta üle kahe korra rohkem kui sahhariidid või valgud).
Rasvu kasutatakse ka naturaalse seebi valmistamiseks. Selleks hüdrolüüsitakse rasvades olevad estersidemed leelisega ning saadakse rasvhapete naatriumisoolad ja glütserool. Kõnekeeles nimetataksegi estrite aluselist hüdrolüüsi seebistamiseks ja naatriumhüdroksiidi seebikiviks. Kuigi seebina on läbi aegade tuntud rasvhapete soolade segu, on poes müüdava „seebi“ koostises küll sageli hoopis sünteetilised pesemisvahendeid.
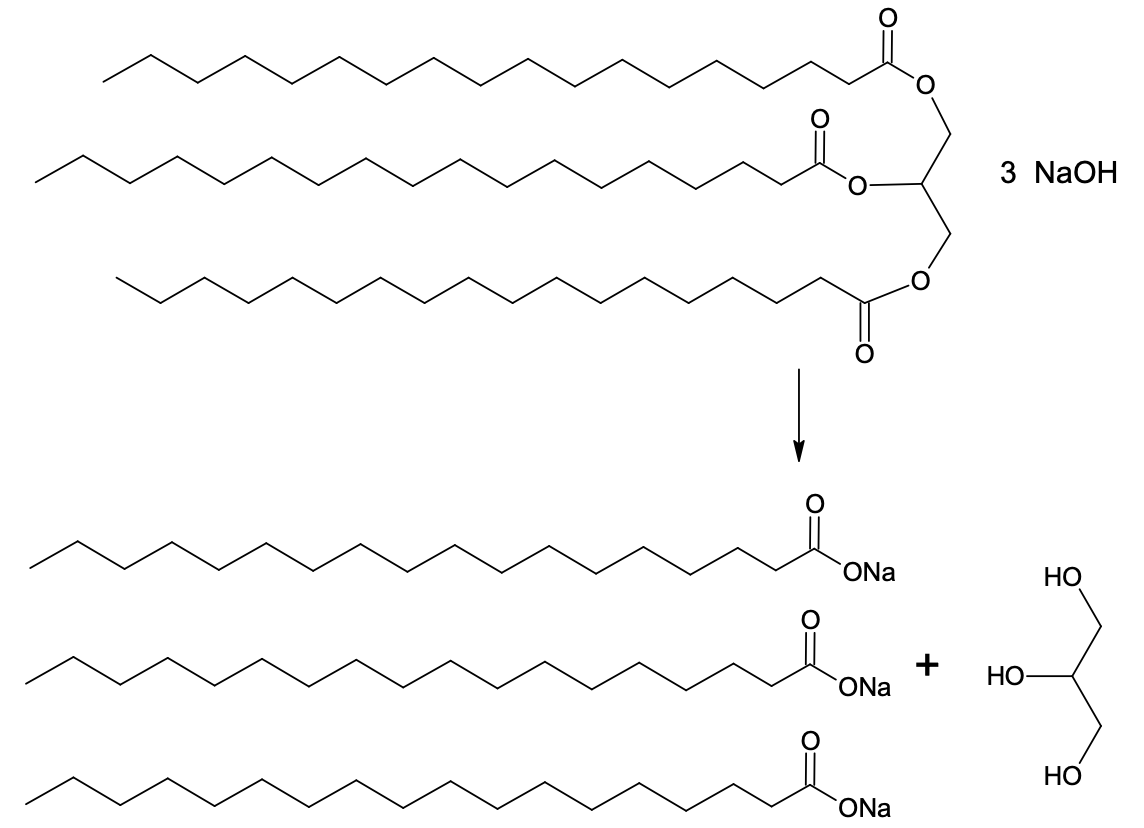
Joonis 2. Seebi saamisreaktsioon
Sahhariidid
Sahhariidid ehk süsivesikud sisaldavad mitut hüdroksüülrühma ning lisaks veel karbonüülset süsinikku, st kuuluvad samaaegselt alkoholide ja ka ketoonide või aldehüüdide aineklassidesse. Monosahhariidi molekulis on üks karbonüülrühm ja mitu hüdroksüülrühma (monosahhariid on nt glükoos ehk viinamarjasuhkur ja fruktoos ehk puuviljasuhkur). Suuremad monosahhariidimolekulid esinevad peamiselt tsüklilisena, sest hüdroksüülrühm reageerib molekulisiseselt karbonüülrühmaga. Monosahhariidimolekulid võivad reageerida ka üksteisega ja moodustada suuremaid sahhariidimolekule. Lihtsamaid sahhariide, mis koosnevad ühest või kahest monosahhariidist, kutsutakse suhkruteks. Näiteks sahharoos on saadud fruktoosi- ja glükoosimolekulist. Oligosahhariidid sisaldavad 3 kuni mõnikümmend monosahhariidiühikut. Kui monosahhariide on molekuli struktuuri ühendatud veelgi enam, siis on aine polüsahhariidid.
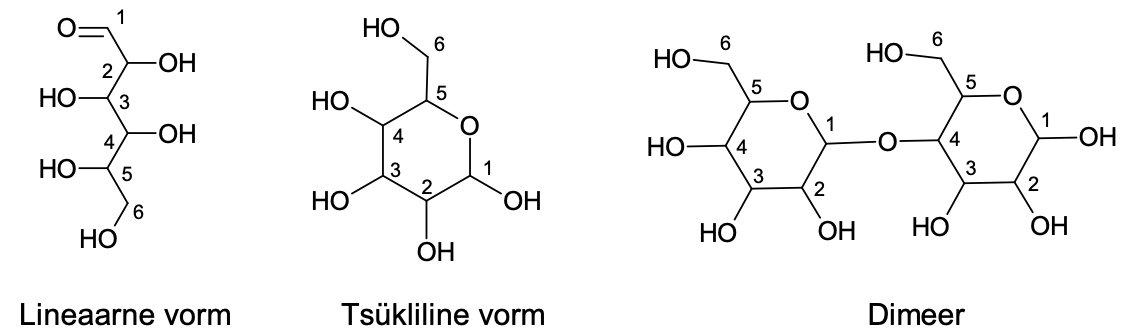
Joonis 3. Näited süsivesikute erinevatest vormidest. Monosahhariid lineaarses ja tsüklilises vormis. Paremal on näidatud, kuidas kaks monosahhariidi on ühinenud dimeeriks (disahhariidiks). Oligosahhariidides ja polüsahhariidides on palju selliseid ühendusi
Sahhariidid on esmased energiaallikad ja ka olulised energiarikkad varuained. Sahhariidide energiasisaldus on küll enam kui kaks korda väiksem kui rasvade oma (massiühiku kohta), aga nende kasutamine on mõnedel juhtudel organismide jaoks eelistatud. Taimede varuaineks on polüsahhariid tärklis, mis on inimestele toidu koostises tähtis energiaallikas. Inimkehas olev tärklisesarnane varuaine on glükogeen. Polüsahhariidid on ka mitmed looduses levinud struktuursed ained nagu tselluloos ja kitiin. Tselluloosist koosneb taimerakke ümbritsev kest ning ka paljud taimsed kiud (nt puuvill) on moodustunud tselluloosist. Kitiinist kest ümbritseb lülijalgseid organisme.
Valgud
Valgud on looduslikud polüamiidid ehk polümeerid, mille ehituskivid on omavahel seotud amiidsidemetega. Valkude amiidsidemeid nimetatakse biokeemias tihti ka peptiidsidemeteks ning lühemaid valgujuppe peptiidideks. Kui sünteetilised polüamiidid on üldiselt tekkinud identsetest ühikutest, siis valgud on tavaliselt kokku pandud 20 erinevast aminohappest. Tavalise polümeermaterjali koostises on segu erineva molekulmassiga molekulidest, kuid iga kindla valgu molekulis on identse pikkuse ja sama aminohapete järjestusega polüpeptiidahelad. Valkude süntees toimub täpselt geenijärjestusse kodeeritud info alusel. Selline struktuuri ja valgumolekulide omaduste korratavus võimaldab organismil valmistada valke, mis täidavad väga spetsiifilisi funktsioone.
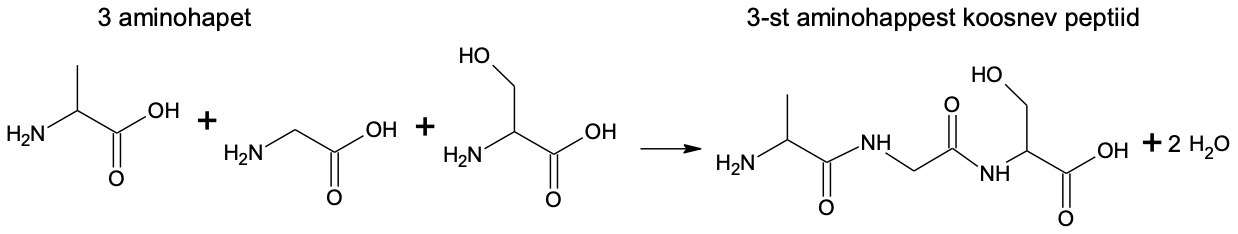
Joonis 4.Tripeptiidi moodustumine aminohapetest. Valkudes sisalduvad peptiidiahelad on pikemad ja ühtekokku võib valgus sisaldub sadu ja isegi tuhandeid aminohappejääke
Valkude sünteesil kasutatavad aminohapped on mitmekülgsete omadustega, mistõttu moodustub eluslooduses palju erinevate omadustega valke. Elusorganismides toimuvad keemilised reaktsioonid on enamasti katalüüsitud ensüümide poolt ja pea kõik ensüümid on struktuurilt valgud. Väga paljud valgud omavad ka struktuurset rolli. Näiteks nahk, küüned, kõõlused, kõhred ja juuksed on peamiselt valgulise ehitusega. Lisaks on organismides palju valgulisi struktuure, mis asuvad rakkude sees. Valgud on ka raku pinnal olevad retseptorid (bioloogilist signaalide ülekannet vahendavad valgud) ja toitainete transporterid (lasevad kindlaid aineid rakku). Immuunsuse juures on oluline roll kindlatel valkudel – antikehadel. Mitmed hormoonid on valgulise ehitusega. Seega võib valke lugeda elu seisukohast kõige olulisemaks biomolekulide aineklassiks. Meie DNA-s olev geneetiline info realiseerub suures osas keha poolt toodetavates valkudes. Valgud määravad seega, millised me olema ja kuidas toimime.
Igapäevaelus tuttavatest materjalidest koosnevad valkudest loomset päritolu kiud nagu vill, siid ja ämblikuvõrk.
7.2. Eetrid
Eetri üldvalem: R1–O–R2
Eetrid on orgaanilised ained, kus hapnikuaatomiga on seotud kaks alküülrühma R–O–R. Eetrite omadustega saad tutvuda järgmises videos.
Allikas: https://youtu.be/4ZgbXhqCCAc
Eetrites ei leidu vesiniksidemeid ja eetrid on vähepolaarsed ained.
Eetrimolekulid ei saa omavahel vesiniksidemeid moodustada ning eetrid on seetõttu üsna vähepolaarsed ained. Vesiniksidemete puudumise tõttu on väiksemate molekulidega eetrid kergesti lenduvad (madala keemistemperatuuriga) ning lahustuvad vees suhteliselt halvasti (kuna eetrid on polaarsemad kui süsivesinikud, lahustuvad eetrid siiski süsivesinikest paremini). Eetrid on väiksema reaktsioonivõimega kui alkoholid. Kõige tuntum eeter on dietüüleeter, mida kasutatakse lahustina. Igapäevaelu toodetes (kosmeetikatooted, hambapastad jms) kasutatakse sageli polümeerset eetrit polüetüleenglükooli (PEG).
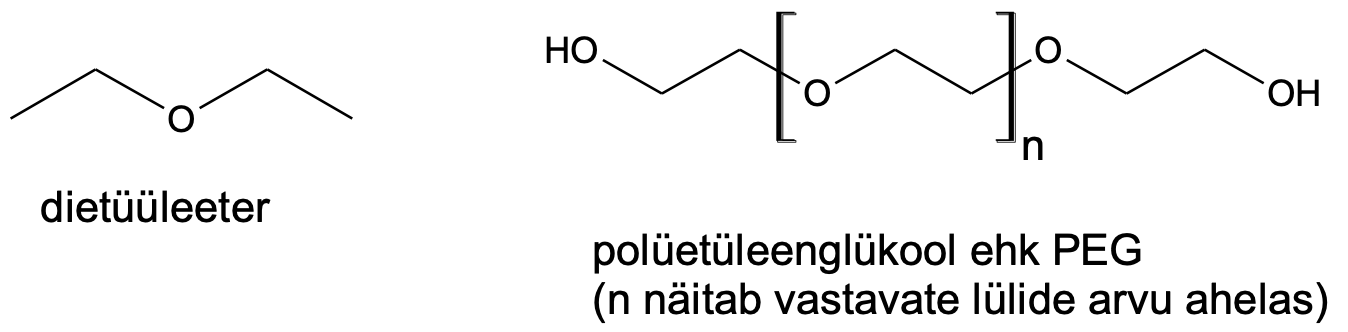
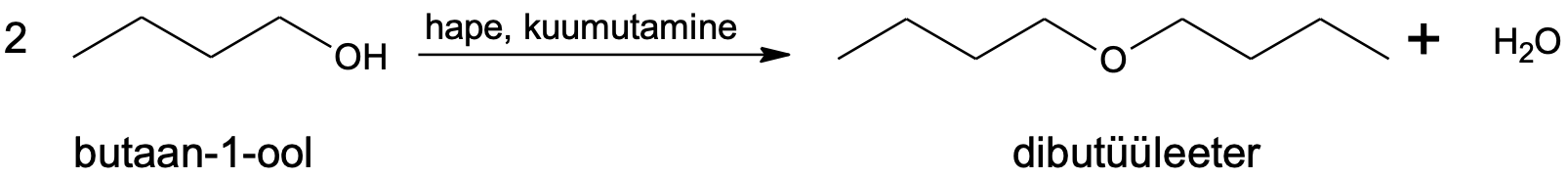
Lihtsamaid eetreid valmistatakse alkoholidest.
7.3. Amiinid
Allikas: https://youtu.be/PrAQtF6xAbY
Amiinid saadakse ammoniaagi molekulis ühe või mitme vesinikuaatomi asendamisel alküülrühmaga. Vastavalt sellele, kas asendatud on üks, kaks või kolm vesinikku, jaotatakse amiine primaarseteks, sekundaarseteks ja tertsiaarseteks amiinideks. Amiinid on tihti ebameeldiva lõhnaga (nt kala- või laibalõhn) ained, mida looduses tekib eriti orgaaniliste ainete lagunemisel.
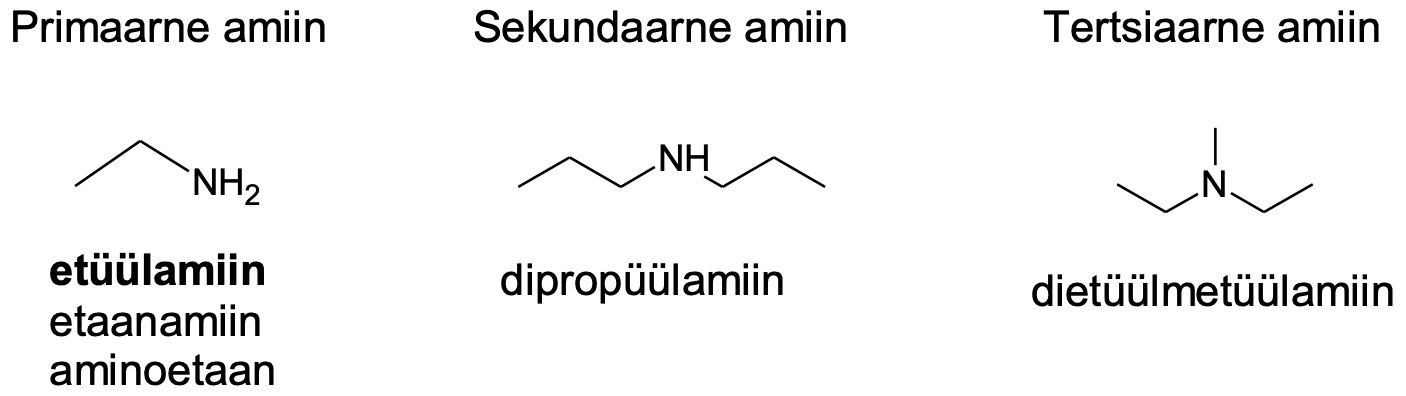
Joonis 1. Näiteid amiinidest
Etüülamiin on esimese aine kõige levinum nimetus, aga korrektsed on ka etaanamiin ja aminoetaan. Eesliide „amino“ on –NH2 korral eelistatud keerukamate ühendite nimetamisel.
Amiinide omadused
Amiinid on polaarsed ja hüdrofiilsed ained.
Amiinid on polaarsed ja hüdrofiilsed ained. Sarnaselt alkoholidele annavad primaarsete ja sekundaarsete amiinide molekulid omavahel vesiniksidemeid. Kuna amiinimolekulide vahel on nõrgemad vesiniksidemed kui alkoholimolekulide vahel, on amiinide keemistemperatuurid üldiselt madalamad kui võrreldava suurusega alkoholidel, kuid siiski kõrgemad kui mitte- või vähepolaarsetel ühenditel.
Tabel 1. Lihtsamate amiinide keemistemperatuurid
|
Amiin |
CH3NH2 |
CH3CH2NH2 |
CH3(CH2)2NH2 |
CH3(CH2)3NH2 |
CH3(CH2)4NH2 |
|
Keemis-temperatuur, °C |
–6 |
18 |
49 |
78 |
102 |
Amiinid on sarnaselt ammoniaagiga nõrgad alused ning reageerivad hapetega, andes vastava ammooniumsoola. Nagu ammoniaagi puhul, toimub ka aminorühma reaktsioon happega nii, et lämmastiku vaba elektronipaar seob vesinikiooni.

Joonis 2. Propüülamiini reaktsioon vesinikkloriidhappega
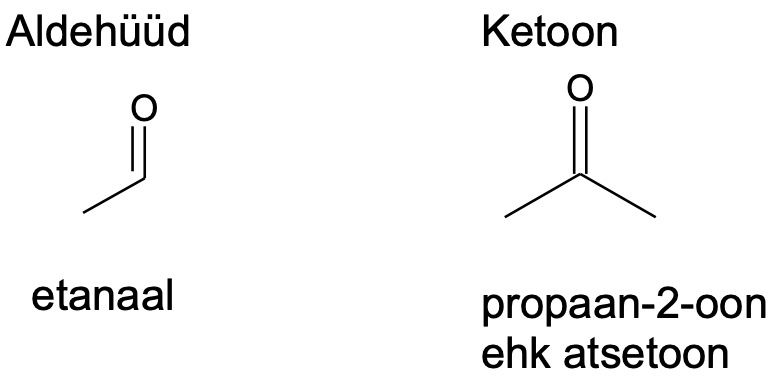
7.4. Aldehüüdid ja ketoonid
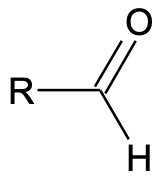
Aldehüüdi üldvalem: R–CHO
Ketooni üldvalem: R1–CO–R2
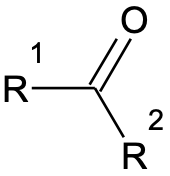
Aldehüüdid ja ketoonid on orgaanilised ained, milles sisaldub karbonüülrühm C=O. Karbonüülrühmas on süsiniku ja hapniku vahel kaksikside. Aldehüüdides on karbonüülrühm süsinikahela otsas ning vastav aldehüüdrühm omab struktuuri –CHO. Ketoonides on karbonüülrühm süsinikahela keskel (ketorühm –CO–).
Aldehüüdidest on tuntuim metanaal ehk formaldehüüd (HCHO), mida kasutatakse näiteks polümeersete materjalide lähteainena. Metanaali vesilahust tuntakse formaliinina ja teda kasutatakse desinfitseerimiseks ning ka kudede säilitamisel (nt muuseumieksponaatide valmistamisel elunditest). Etanaal on aldehüüd, mis on etanooli ainevahetuse vahesaadus (seostatakse nt pohmeluse tekkega).
Ketoonidest on tuntuim atsetoon, mis on levinud lahusti.
Karbonüülrühma sisaldavad ained on küll polaarsed, kuid nende ainete molekulid ei anna omavahel vesiniksidemeid. Lühema ahelaga karbonüülühendid lahustuvad siiski vees hästi, sest karbonüülrühma hapnik võib anda vesiniksidet vees sisalduva vesinikuga.
Aldehüüdid ja ketoonid kui alkoholide oksüdeerumissaadused
Aldehüüdid ja ketoonid tekivad alkoholide osalise oksüdeerumise käigus.
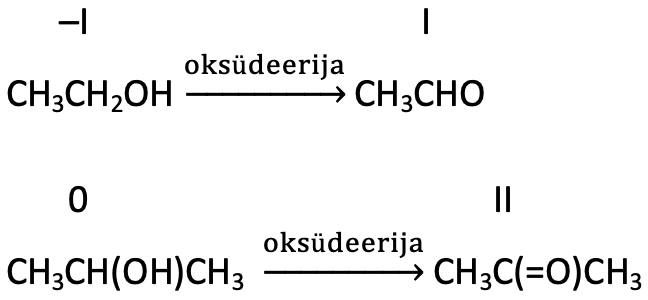
Alkoholide oksüdeerumisel tekivad aldehüüdid ja ketoonid.
Näeme, et selle reaktsiooni käigus kasvab algselt hüdroksüülrühmaga seotud süsiniku oksüdatsiooniaste ja tegemist on tõepoolest redoksreaktsiooniga.
Aldehüüdid on head redutseerijad ja võivad edasi oksüdeeruda. Aldehüüdide edasisel osalisel oksüdeerumisel tekivad karboksüülhapped.
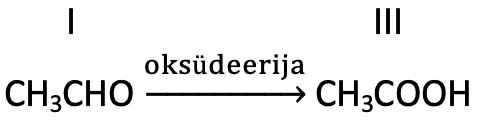
Aldehüüdide oksüderumisel tekivad karboksüülhapped.
Nii oksüdeeritakse näiteks etanool lõppkokkuvõttes etaanhappeks ehk äädikhappeks. Ka organismi sattunud alkohol oksüdeeritakse esmalt aldehüüdiks ja seejärel karboksüülhappeks. Teatud bakterite kaasabil oksüdeeruvad õhuhapniku toimel lahjad alkohoolsed joogid. Seda protsessi kasutatakse veiniäädika valmistamiseks.
On võimalik läbi viia ka toodud reaktsioonidele vastupidiseid reaktsioone. Nii karboksüülhappeid kui ka aldehüüde ja ketoone saab õigetes tingimustes redutseerida ning saada nii näiteks alkohole.
7.5. Karboksüülhapped
Allikas: https://youtu.be/cRV-yOIHj28
Karboksüülhappe üldvalem:
R–COOH
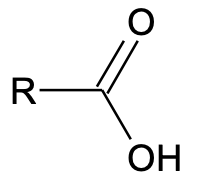
Karboksüülhapped sisaldavad karboksüülrühma –COOH ehk –C(O)–OH. Karboksüülrühm on tugevalt polaarne ja annab vesiniksidemeid, mistõttu lahustuvad lühema ahelaga karboksüülhapped vees hästi. Tuntuimad karboksüülhapped on metaanhape ehk sipelghape (HCOOH) ja etaanhape ehk äädikhape (CH3COOH). Pika ahelaga karboksüülhappeid nimetatakse rasvhapeteks.
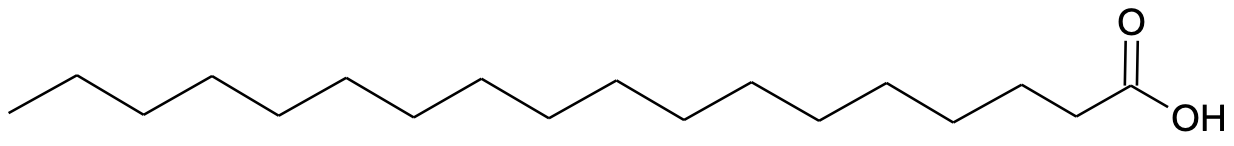
Joonis 1. Oktadekaanhape ehk steariinhape on tüüpiline rasvhape
Keemilised omadused
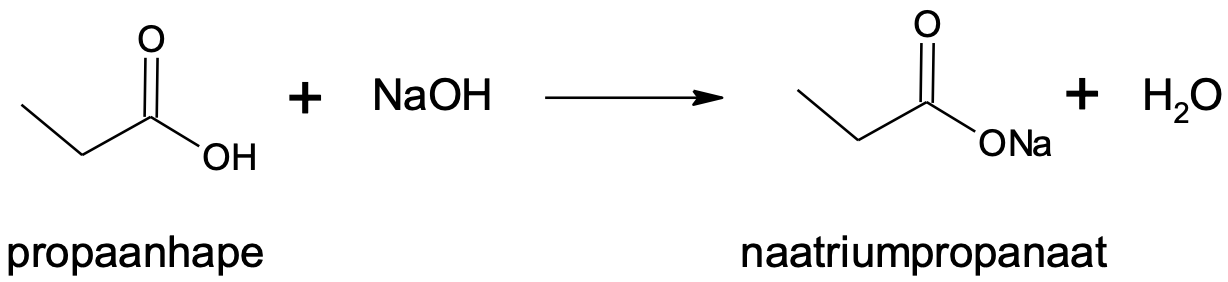
Nagu juba aineklassi nimest lähtub, käituvad karboksüülhapped hapetena. Võrreldes tüüpiliste tugevate hapetega (nt HCl, HNO3, H2SO4) on karboksüülhapped oluliselt nõrgemad happed, kuid siiski on nad üpris happelised ained. Karboksüülhapete soolad on vastavad karboksülaadid.
Karboksüülrühm annab reaktsioonitüüpe, mis on iseloomulikud ka anorgaanilistele hapetele.
1) Neutralisatsioonireaktsioon:
CH3CH2COOH + NaOH → CH3CH2COONa + H2O
2) Reaktsioon aluselise oksiidiga:
2 CH3COOH + CaO → (CH3COO)2Ca + H2O
3) Reaktsioon aktiivse või suhteliselt aktiivse metalliga:
2 CH3COOH + Ca → (CH3COO)2Ca + H2↑
4) Reaktsioon nõrgema/ebapüsivama happe soolaga:
2 HCOOH + CaCO3 → (HCOO)2Ca + H2O + CO2↑
Lisaks anorgaanilistele hapetele iseloomulikele reaktsioonidele annavad karboksüülhapped ka reaktsioone, mille käigus moodustuvad orgaanilised karboksüülhapete derivaadid – estrid või amiidid. Neid reaktsioone vaatlemegi järgnevalt.
7.6. Estrid
Allikas: https://youtu.be/jojq9IijCSM
Estri üldvalem: R1–COO–R2
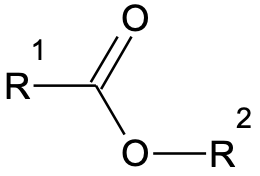
Estrid on karboksüülhapete derivaadid, mida saadakse karboksüülhappe ja alkoholi vahelisel reaktsioonil (teise saadusena tekib vesi). Estrite valmistamisel kasutatakse tavaliselt katalüsaatorina tugevat hapet ja soojendamist.
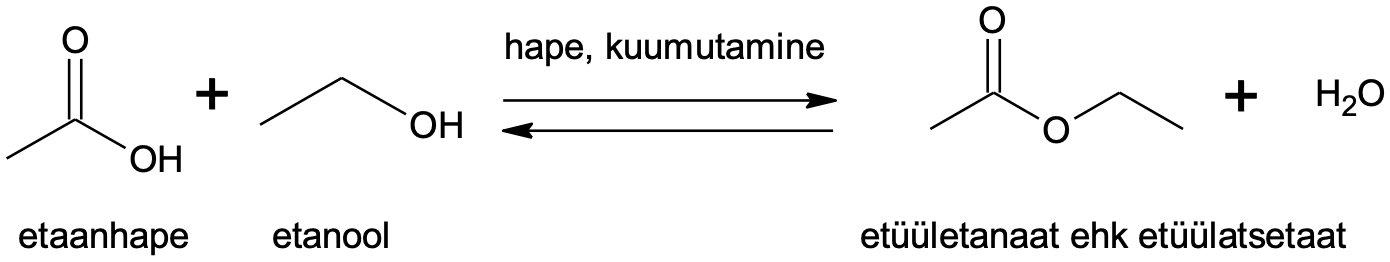
Joonis 1. Estri saamisreaktsioon
Estri saamine on pöörduv reaktsioon ja ester võib hüdrolüüsuda lähteaineteks.
Estri moodustumine on pöörduv reaktsioon, aga katalüsaator kiirendab reaktsiooni mõlemas suunas. Seetõttu on õigetes tingimustes (kokkupuude veega happelises keskkonnas) estreid võimalik hüdrolüüsida tagasi karboksüülhappeks ja alkoholiks, mis on estri moodustumise pöördreaktsioon. Ka aluseline keskkond kiirendab estri hüdrolüüsi, kuid aluselises keskkonnas moodustub karboksüülhappe asemel selle sool.
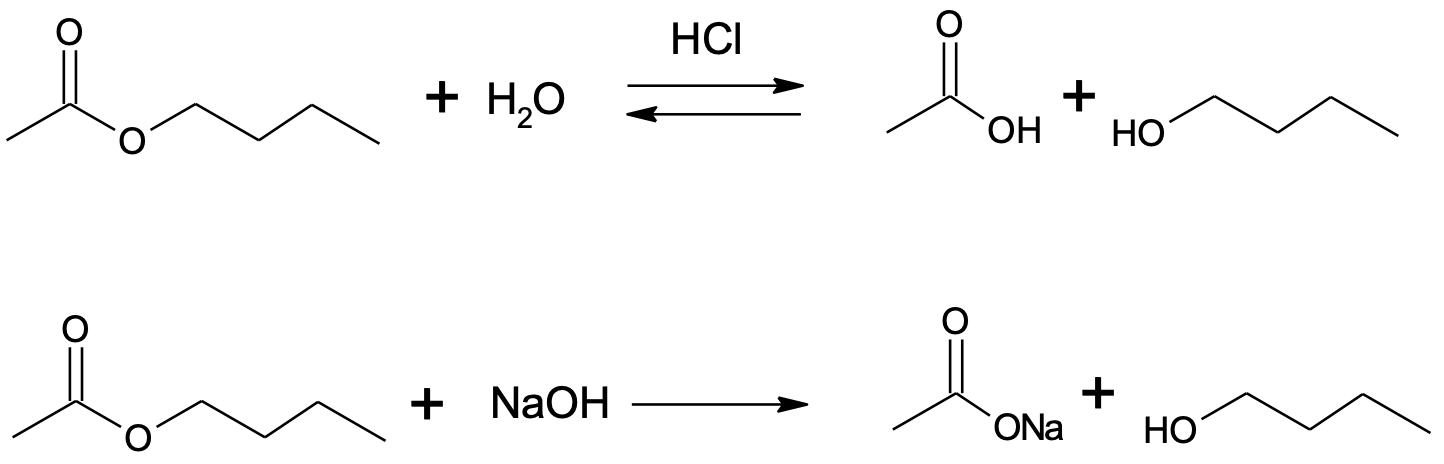
Joonis 2. Estri happeline hüdrolüüs (üleval) ja estri aluseline hüdrolüüs (all)
Ka seebi saamisreaktsioon („seebi keetmine“) on estri – rasva – aluseline hüdrolüüs.
Väiksema molekuliga estrid on meeldiva puuviljalõhnaga vedelikud. Estrid on mõõdukalt polaarsed või vähepolaarsed ained (polaarsemad kui eetrid, ent vähem polaarsed kui aldehüüdid või ketoonid), nende molekulid ei anna omavahel vesiniksidemeid. Lühema süsinikahelaga estrite molekulid lahustuvad vees suhteliselt vähe, pikema süsinikahelaga estrid vees praktiliselt ei lahustu. Rasvad ja looduslikud vahad on estrid. Polüestritest valmistatakse nt tehiskiude.
7.7. Amiidid
Allikas: https://youtu.be/K3dIOZOLTOA
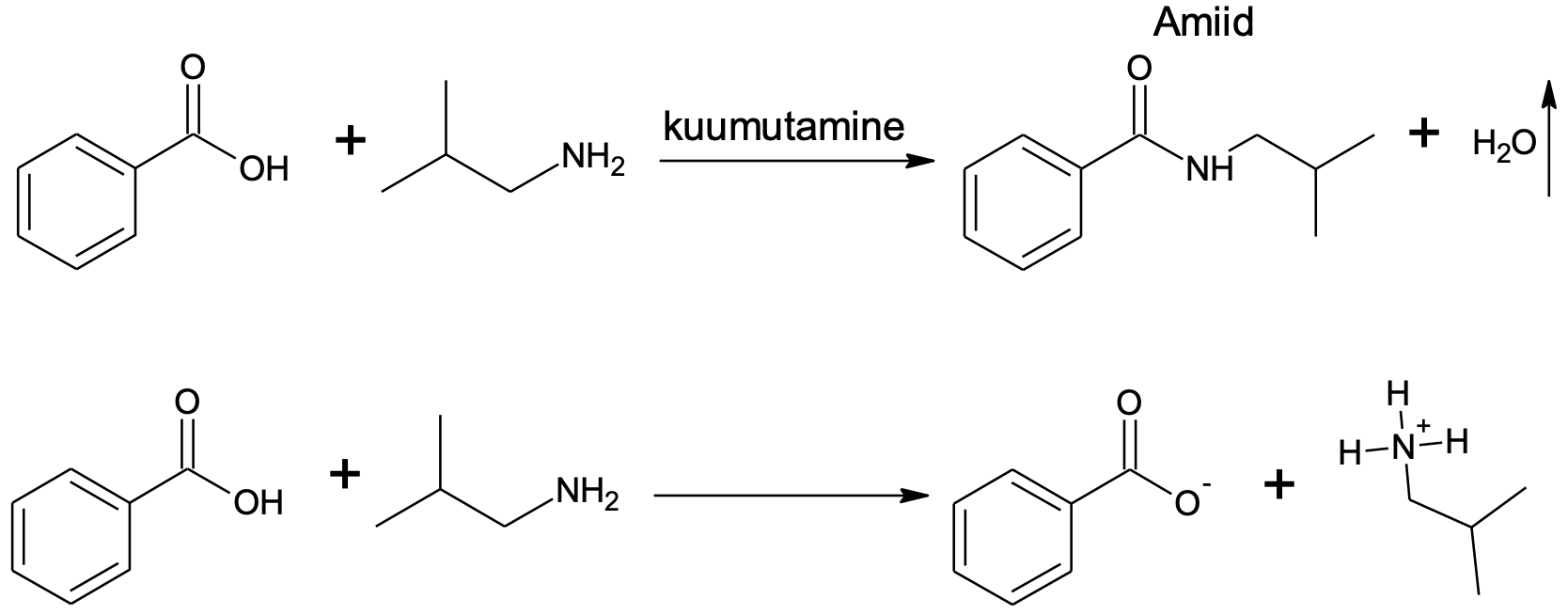
Amiidid tekivad karboksüülhappe ja amiini vahelisel reaktsioonil, kus eraldub sarnaselt estri tekkereaktsioonile vesi. Praktikas vajab selline amiidi saamine väga tugevat kuumutamist ning enamasti saadakse amiide teistest karboksüülhapete derivaatidest. Ilma tugevalt kuumutamata tekib karboksüülhappe (hape) ja amiini (alus) reageerimisel sool.
Joonis 1. Tugeval kuumutamisel annab karboksüülhappe ja amiini vaheline reaktsioon amiidi, tavatemperatuuril soola
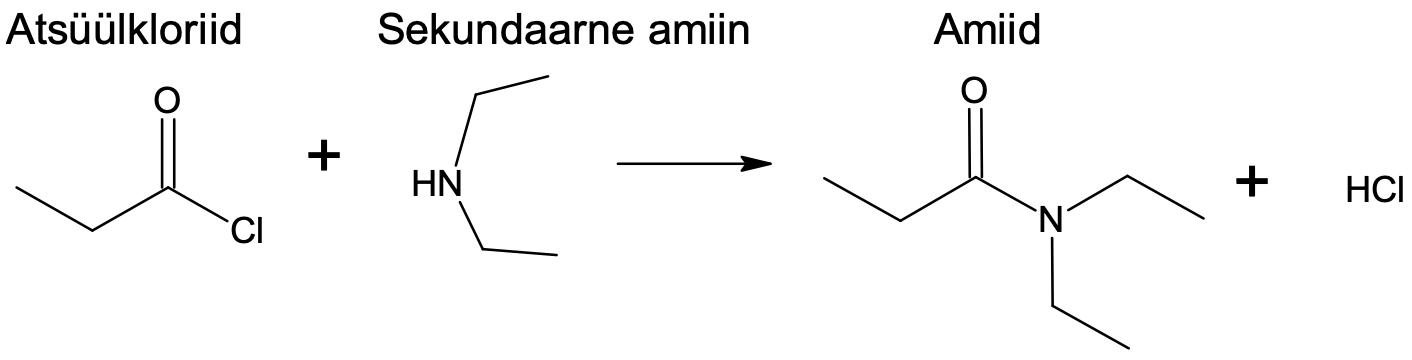
Tavapärane amiidi süntees lähtub aktiveeritud karboksüülhappederivaadist. Näiteks võib karboksüülhappest valmistada atsüülkloriidi, mis amiiniga soola ei anna, kuid annab väga kergesti amiidi. Sellised reaktsioonid kulgevad kiiresti juba toatemperatuuril.
Joonis 2. Amiidi saamine atsüülkloriidi ja sekundaarse amiini reageerimisel
Amiidid on keemiliselt väga stabiilsed ning nende hüdrolüüs karboksüülhappeks või selle soolaks ning amiiniks vajab tugeva happe või aluse katalüüsi ja pikka kuumutamist.

Joonis 3. Amiidi hüdrolüüs on väga aeglane ja vajab happe, aluse või ensüümi katalüüsi
Amiidid on tugevalt polaarsed ained ja nende molekulid võivad anda vesiniksidemeid. Eluslooduses on kõige olulisemad amiidid valgud ehk proteiinid. Valkudes olevad aminohappejäägid on omavahel seotud läbi amiidsidemete. Amiidsidet nimetatakse biokeemias tihti ka peptiidsidemeks. Amiidid on olulised ka seetõttu, et kasutatakse palju amiidseid polümeere - polüamiide, näiteks nailonit ja kevlarit.
7.8. Orgaaniliste ainete klasside kokkuvõte
Tabel 1. Orgaaniliste ainete polaarsus
|
Praktiliselt mittepolaarsed ained |
Vähepolaarsed ained |
Mõõdukalt |
Tugevalt polaarsed ained |
|
Süsivesinikud |
Eetrid, estrid, halogeeniühendid |
Amiinid, aldehüüdid, ketoonid |
Amiidid, karboksüülhapped, alkoholid |
Tabel 2. Aineklassid ja vesiniksidemed
|
Funktsionaalrühm/ |
Aineklass |
Kas molekulid annavad omavahel vesiniksidemeid? |
|
–OH |
alkohol |
jah |
|
–O– |
eeter |
ei |
|
–NH2, –NHR, –NR2 |
amiin |
jah, v.a –NR2 |
|
–CHO |
aldehüüd |
ei |
|
–CO– |
ketoon |
ei |
|
–COOH |
karboksüülhape |
jah |
|
–COO– |
ester |
ei |
|
–CONH2, –CONHR, –CONR2 |
amiid |
jah, v.a –CONR2 |
Olulisemad reaktsioonid
- alkaan + halogeen → halogeeniühend + vesinikhalogeniid (toimumiseks on vaja UV-kiirgust või kuumutamist)
- alkeen + halogeen → halogeeniühend
- alkeen + vesinikhalogeniid → halogeeniühend
- alkeen + vesinik → alkaan (toimumiseks on vaja katalüsaatorit, nt Pt)
- areen + halogeen → halogeeniühend + vesinikhalogeniid (toimumiseks võib olla vajalik katalüsaatori, nt Fe3+- või Al3+-soola kasutamine)
- alkoholi oksüdeerumine → aldehüüd või ketoon
- aldehüüdi oksüdeerumine → karboksüülhape
- karboksüülhape + alus → karboksüülhappe sool + vesi
- karboksüülhape + aluseline oksiid → karboksüülhappe sool + vesi
- karboksüülhape + (suhteliselt) aktiivne metall → karboksüülhappe sool + vesinik
- karboksüülhape + nõrgema/ebapüsivama happe sool → karboksüülhappe sool + nõrgem hape (kui tekib H2CO3, laguneb see süsinikdioksiidiks ja veeks)
- karboksüülhape + alkohol → ester + vesi (toimumiseks on vaja katalüsaatorit, nt hapet)
- ester + vesi → karboksüülhape + alkohol (toimumiseks on vaja katalüsaatorit, nt hapet)
- ester + leelis → karboksüülhappe sool + alkohol
7.9. Polümeerid
Polümeerimolekul koosneb korduvatest lõikudest (elementaarlülidest).
Mõiste “polümeer“ tuleneb kreekakeelsetest sõnadest poly (palju) ja mer (osi). Seega on polümeerid suure molekuliga ained, mis on tekkinud väiksematest molekulidest (monomeeridest). Polümeerimolekuli moodustavad korduvad struktuuriosad: monomeeridest pärinevad n-ö elementaarlülid.
Polümeeride kohta vaata lähemalt järgmisest videost.
Allikas: https://youtu.be/uJg0-6MlFiA
Polümeeride molekulmassid algavad mõnest tuhandest ja suuremate molekulide korral ulatuvad miljonitesse. Ristseotud polümeeride korral on polümeeriahelad omavahel kovalentsete sidemetega seotud ja materjalis eraldiseisvaid molekule eristada ei saagi.
Polümeere saab jaotada nende päritolu (looduslik või sünteetiline), lähtemonomeeri või polümerisatsioonireaktsiooni tüübi järgi, struktuuri alusel (lineaarne, hargnenud või ristseotud) jne. Polümeeride peamine rakendusvaldkond on erinevate polümeersete materjalide (plastid, kummid jt) valmistamine (neis on polümeer põhikomponent). Eluslooduse seisukohast on eriti olulised biopolümeerid: nukleiinhapped (DNA ja RNA), valgud ja polüsahhariidid (nt tselluloos, tärklis ja kitiin).
Tehispolümeeridest on kõige levinumad ja tuntumad alkeenide polümerisatsioonil saadavad polümeerid. Nelja kõige olulisema tehispolümeeri saamist kujutavad järgmised skeemid. n tähistab neis skeemides reageerivate monomeeride arvu.
n CH2=CH2 → [CH2–CH2]n
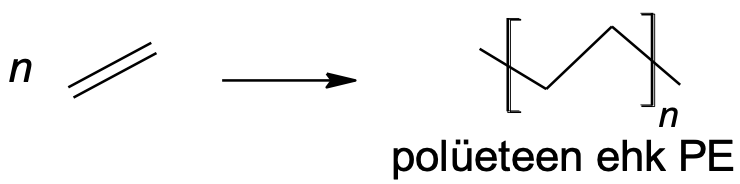
Joonis 1. Polüeteeni (polüetüleeni) saamine
n CH2=CH–CH3 → [CH2–CH(CH3)]n
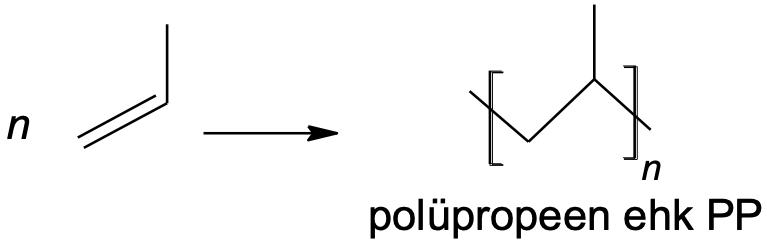
Joonis 2. Polüpropeeni (polüpropüleeni) saamine
n CH2=CH–Cl → [CH2–CHCl]n
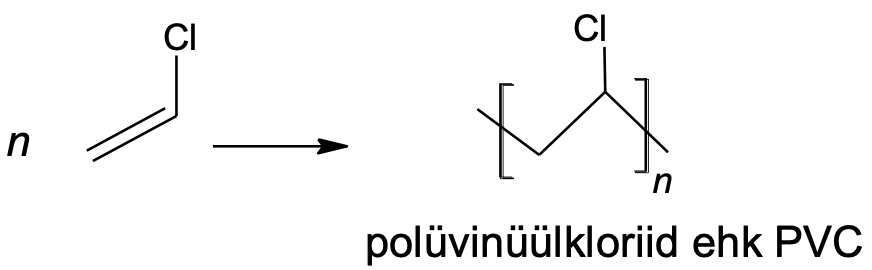
Joonis 3. Polüvinüülkloriidi saamine
n C6H5–CH=CH2 → [CH(C6H5)–CH2]n
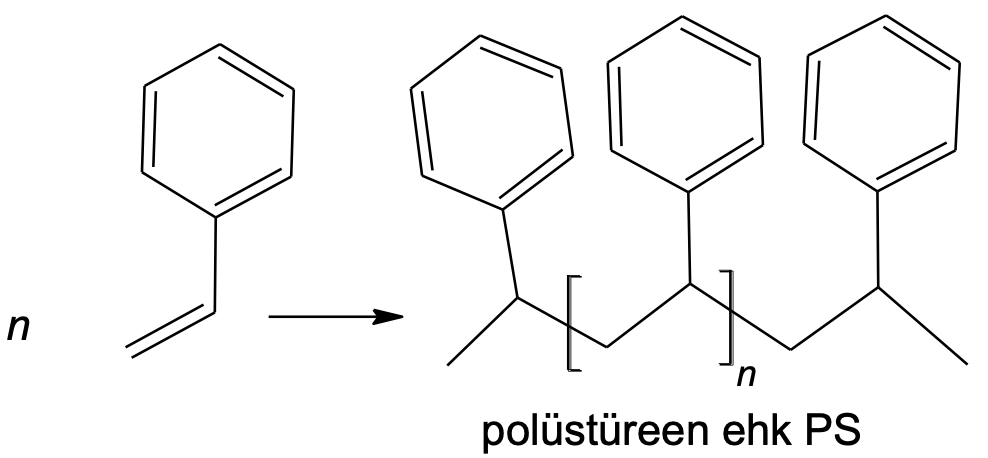
Joonis 4. Polüstüreeni saamine
Liitumispolümerisatsioonil liituvad monomeerimolekulid üksteisega ja kaksiksidemed asenduvad üksiksidemetega.
Polükondensatsioonil liituvad monomeerimolekulid üksteisega ja eraldub ka väikese molekulmassiga aine.
Liitumispolümerisatsioonil liituvad monomeerimolekulid üksteisega, mille käigus asenduvad kaksiksidemed üksiksidemetega. Polükondensatsioonil liituvad monomeerimolekulid üksteisega ja eraldub ka väikese molekulmassiga aine.
Alkeenid annavad liitumispolümerisatsiooni, kuid lisaks liitumispolümerisatsioonile on oluline polümeeride saamise viis polükondensatsioon. Kondensatsiooniks nimetatakse reaktsiooni, kus kaks orgaanilist ainet ühinevad ning teise saadusena eraldub väikese molekulmassiga aine (näiteks vesi või HCl). Polükondensatsiooni korral toimub rida järjestikuseid kondendatsioonireaktsioone ning moodustuvad pikad polümeeride ahelad. Kõige levinum on polükondensatsioonil estrite (polüestrid) või amiidide (polüamiidid) valmistamine.
n HO–CH(CH3)–COOH → H-[-O–CH(CH3)–CO-]n-OH + n – 1 H2O
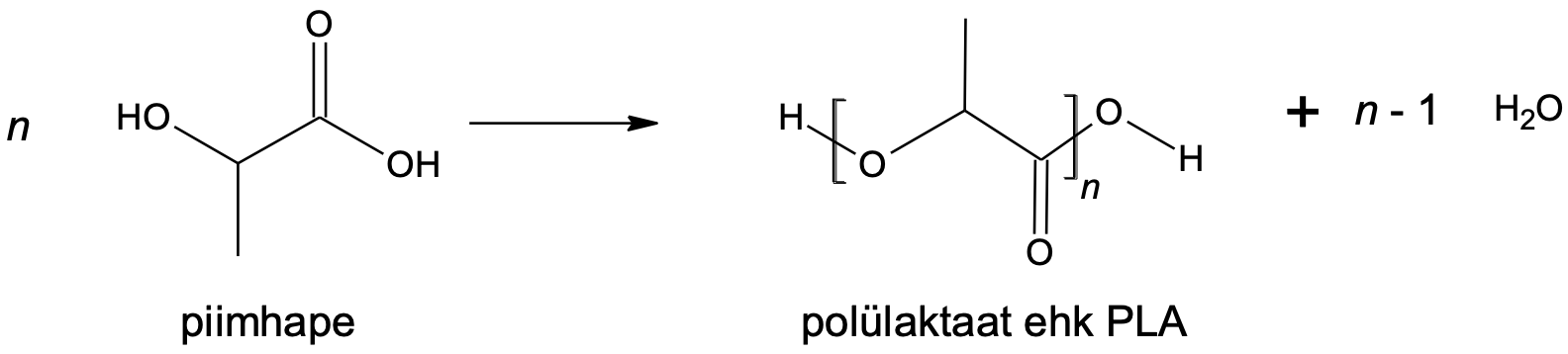
Joonis 5. Polüestri tekke näide
Piimhappe karboksüülrühmad ja hüdroksüülrühmad moodustavad estersidemeid, mille läbi tekivad pikad ahelad. Iga estersideme tekkel eraldub üks vee molekul. Kui tihti on probleemiks polümeeride väga aeglane lagunemine looduses, siis polülaktaat ehk PLA on tuntuim näide biolagunevast polümeerist, sest estersidemed saavad hüdrolüüsuda, andes tagasi piimahappe.
Teine näide polükondensatsioonil saadavatest polümeeridest on polüamiidid, mille ühe esindaja struktuur on toodud ka joonisel.
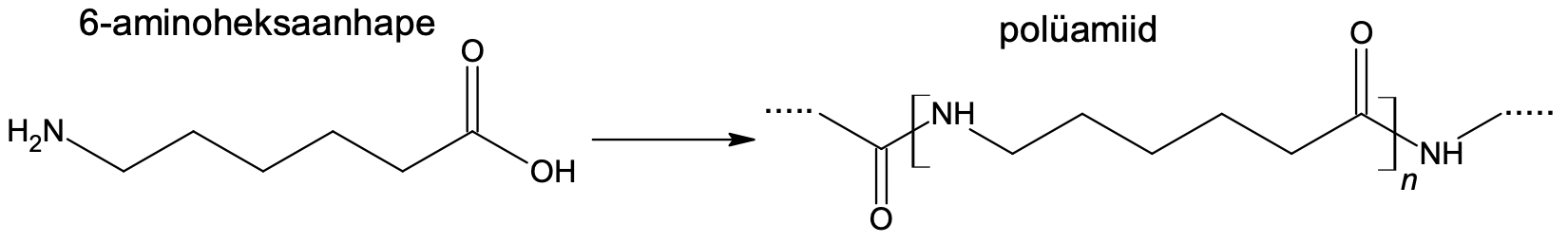
Joonis 6. Polüamiidi struktuur
Polüamiidide ahelate vahel on vesiniksidemed, mis annavad neist valmistatud materjalidele erilise tugevuse. Tuntud polüamiidid on erinevad nailonid ja kevlar. Ka valgud on keemilise struktuuri poolest polüamiidid.