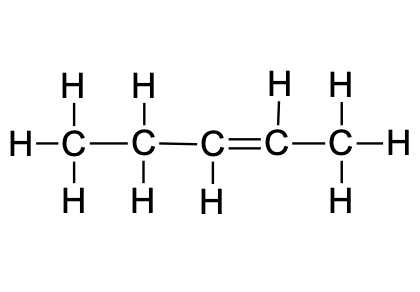
6. Süsivesinikud ja nende derivaadid
Orgaaniline keemia on keemia haru, mis uurib süsinikuühendite (orgaaniliste ainete) struktuuri ja omadusi. Veel 19. saj alguses arvati, et orgaanilised ained moodustuvad vaid elusorganismides. Peagi leiti, et orgaanilisi aineid saab valmistada ka laboris, aga ajalooline nimetus „orgaaniline keemia“ jäi ikkagi kasutusele.
Süsiniku aatom suudab moodustada mitmesuguseid sidemeid nii teiste süsinikuaatomitega kui ka paljude erinevate elementide aatomitega. See süsiniku omadus võimaldab tal moodustada väga mitmekesise struktuuriga orgaanilisi aineid. Süsinikuühendite struktuuri ja omaduste mitmekesisusel põhineb elu Maal. Eluslooduse osana koosneme ka meie vee kõrval peamiselt orgaanilistest ainetest ning sööme neid igapäevaselt oma toidu koostises. Orgaanilisi aineid on kõikjal meie ümber ning inimkond kasutab neid paljudel eesmärkidel. Kiiret tehnoloogilist arengut on suures osas võimaldanud fossiilset päritolu orgaaniliste ühendite põletamisel saadud energia. Viimase sajandi jooksul on kasvanud väga palju orgaaniliste polümeeride kasutamine. Ka enamik ravimeid on orgaanilised ained. Orgaanilise keemia seaduspärasuste mõistmine aitab kaasa paremate otsuste tegemisele tänapäeva maailmas.
6.1. Sissejuhatus orgaanilisse keemiasse
Orgaanilise aine omadused määrab molekuli struktuur: millised aatomid molekulis paiknevad ja kuidas on need aatomid omavahel ühendatud. Orgaanilise keemiaga tegelemisel tuleb osata struktuurivalemeid kirjutada ja lugeda. Selleks tuleb tunda sidemete arve, mis on elementidele iseloomulikud.
Järgnev video võtab kokku orgaanilise keemia põhialused (valemite kirjutamise ja oksüdatsiooniastmete määramise).
Allikas: https://youtu.be/i5jxnz9sL-U
 Loe lisaks: Anorgaanilised ja orgaanilised süsinikuühendid.
Loe lisaks: Anorgaanilised ja orgaanilised süsinikuühendid.
Kõik süsinikuühendid ei kuulu orgaaniliste ühendite hulka, vaid tuntakse ka anorgaanilisi süsinikuühendeid. Näiteks loetakse anorgaaniliste süsinikuühendite hulka CO, CO2, H2CO3 ja karbonaadid. Orgaanilised süsinikuühendid sisaldavad tavaliselt C–H sidemeid, mida anorgaanilised süsinikuühendid enamasti ei sisalda. Samas puudub anorgaaniliste ja orgaaniliste ühendite vahel selge piirjoon ning selle jaotuse aluseks on peamiselt ajalooline traditsioon.
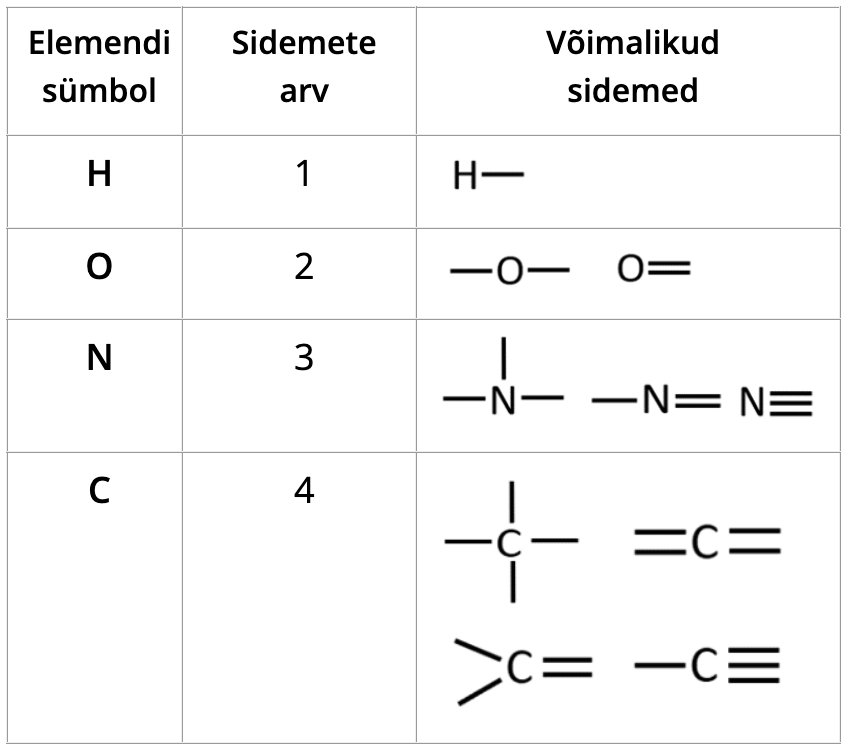
Sidemete arvud süsinikuühendites
Süsinik moodustab orgaanilistes ühendites 4 sidet.
Orgaanilistes ainetes ühendavad aatomeid kovalentsed sidemed (jagatud elektronipaarid).
Ühekordset kovalentset sidet märgitakse enamasti kriipsuna, kaksiksidet kujutatakse kahe paralleelse kriipsuna ja kolmiksidet kolme paralleelse kriipsuna.
Orgaaniliste ainete koostises võib olla erinevaid elemente, kuid kõige olulisemad on süsinik, vesinik, hapnik, lämmastik ja halogeenid.
Süsinik moodustab orgaanilistes ühendites 4 sidet. Seda keskset teadmist tuleb valemite lugemisel või kirjutamisel kogu aeg meeles pidada.
Süsiniku neli sidet võivad jaotuda erinevalt:
- neli üksiksidet,
- üks kaksikside ja kaks üksiksidet,
- kolmikside ja üksikside,
- kaks kaksiksidet.
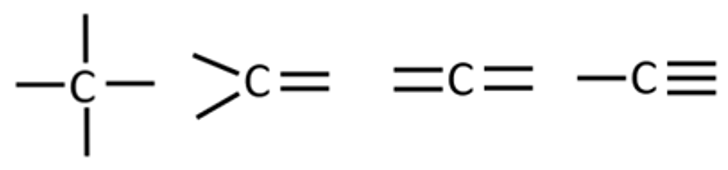
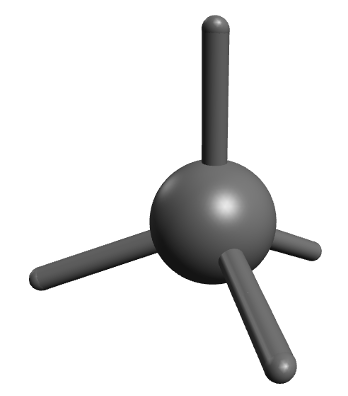 Kuigi pildilt võib jääda mulje, et kõik süsinikuaatomi sidemed paiknevad ühel tasapinnal, paiknevad C aatomiga seotud neli üksiksidet tegelikult ruumiliselt ja on suunatud tetraeedri tippudesse. Seetõttu ei ole ka enamik orgaanilisi aineid tasapinnalised, vaid ruumilise kujuga.
Kuigi pildilt võib jääda mulje, et kõik süsinikuaatomi sidemed paiknevad ühel tasapinnal, paiknevad C aatomiga seotud neli üksiksidet tegelikult ruumiliselt ja on suunatud tetraeedri tippudesse. Seetõttu ei ole ka enamik orgaanilisi aineid tasapinnalised, vaid ruumilise kujuga.
Vesinik ja halogeenid (fluor, kloor, broom, jood) annavad ühe sideme.
Hapnik annab kaks sidet. Need võivad esineda kas kahe üksiksideme või ühe kaksiksidemena.
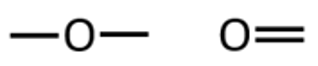
Lämmastik annab kolm sidet. Need sidemed võivad esineda erinevatel viisidel:
- kolm üksiksidet,
- kaksikside ja üksikside,
- kolmikside.
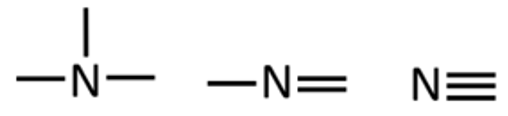
Laenguga aatomite kohta eeltoodud sidemete arvud ei kehti. Kui hapniku aatom omab orgaanilises ühendis negatiivset laengut, on tal vaid üks side, positiivse laenguga lämmastikuaatomil on aga neli sidet. Need sidemete arvud kehtivad näiteks ka anorgaanilisest keemiast tuntud ioonides OH– ja NH4+.
Tabel 1. Sidemete arvud orgaanilistes ühendites
 Loe lisaks: Millest tuleneb elemendi keemiliste sidemete arv?
Loe lisaks: Millest tuleneb elemendi keemiliste sidemete arv?
Elemendi aatom omandab keemilisi sidemeid moodustades stabiilsema (madalama energiaga) oleku. Selleks peab üldreeglina aatom täitma elektronidega täielikult oma väliskihi sarnaselt perioodi lõpus paikneva väärisgaasi aatomiga. Enamiku elementide puhul on selleks vaja 8 elektroni (elektronoktett), vesiniku jaoks kahte elektroni. Elementidele iseloomulikud keemiliste sidemete arvud lähtuvadki vajadusest saada täielikult täidetud väliskiht.
Näiteks süsinik paikneb IVA rühmas ja seetõttu on süsinikuaatomi väliskihis neli elektroni. Süsinikuaatom vajab elektronokteti saamiseks juurde veel nelja täiendavat elektroni. Süsinikuaatom moodustab teiste aatomitega just seetõttu neli jagatud elektronipaari ehk neli kovalentset sidet, kus neli puuduvat elektroni on saadud teiste elementide aatomite väliskihtidest.
Vesinikuaatomi elektronkihis on üks elektron, kuid täielikult täidetud väliskihi jaoks (nagu heeliumi korral) vajab ta veel ühte elektroni.
Näiteks metaanimolekulis on üks süsinikuaatom ja neli vesinikuaatomit. Iga vesinikuaatomi elektron moodustab jagatud elektronipaari süsinikuaatomi elektroniga. Kuna jagatud elektronipaar kuulub mõlemale aatomile, on metaanis iga vesinikuaatomi elektronkihis kaks elektroni ja süsinikuaatomi väliskihis 8 elektroni.
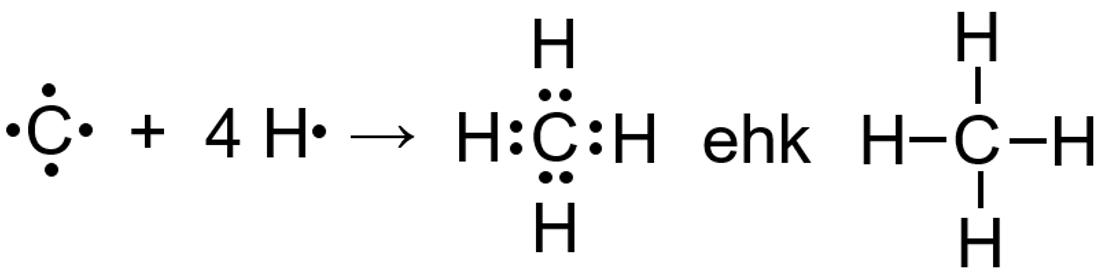
Halogeeni (näiteks kloori) aatomi väliskihis on 7 elektroni, seega vajab halogeeniaatom elektronokteti saamiseks juurde samuti vaid ühte elektroni.
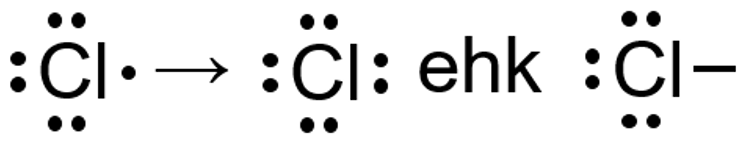
Hapniku (VIA rühma elemendi) aatomi väliskihis on 6 elektroni ning elektronokteti saamiseks piisab kahest täiendavast elektronist.
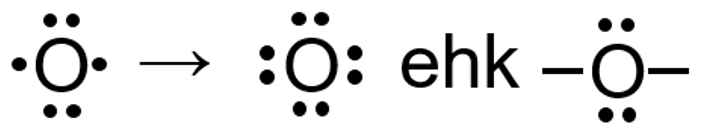
Lämmastiku (VA rühma elemendi) aatomi väliskihis on 5 elektroni ning elektronokteti saamiseks on vaja veel kolme elektroni.
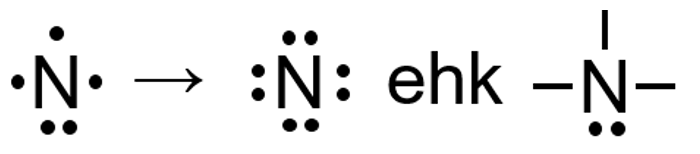
Hapnikuaatomile saab tekkida negatiivne laeng nii, et O–H side katkeb vesinikiooni eemaldamisega hapniku küljest. Selle käigus jääb hapnikuaatomile vaba elektronipaar ning aatomi väliskihis on ikkagi 8 elektroni. Seetõttu ongi negatiivse laenguga O-aatomil ainult üks side. Positiivne laeng saab lämmastikuaatomile tekkida näiteks siis, kui vesinikioon seostub laenguta lämmastikuaatomi vaba elektronipaariga. Nii jääb positiivse laenguga N-aatomile neli sidet. Elektronokteti olemasolu nendes aatomites seletab seega ka erineva sidemete arvu, võrreldes neutraalsete aatomitega. Sarnaselt kehtib oktetireegel ka anorgaanilistes ioonides OH- ja NH4+.
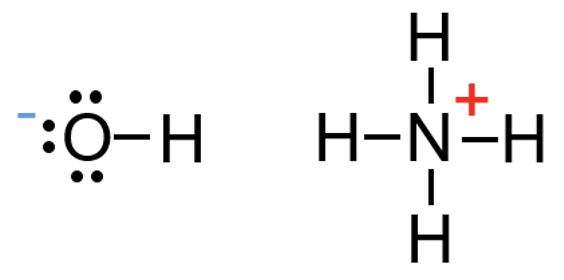
Funktsionaalrühmad
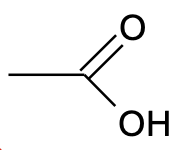 Süsinikuühendi keemilised (ja osalt ka füüsikalised) omadused ja aineklassi määrab see, millised funktsionaalrühmad molekulis lisaks süsinikahelale leiduvad. Näiteks käituvad karboksüülrühma sisaldavad ühendid vesilahuses nõrkade hapetena. Kui asendada hapnikuga seotud vesinikuaatom karboksüülrühmas süsiniku aatomiga (näiteks –CH3 koostises), saame esterrühma, mida sisaldavad ühendid enam vesilahuses happelised ei ole. Oluliselt muutuvad ka aine lahustuvus, keemis- ja sulamistemperatuur jt füüsikalised omadused. Seetõttu on orgaanilises keemias väga oluline jälgida, kuidas on aatomid ühendi molekulis omavahel seotud, sest väike muutus struktuuris võib muuta palju aine omadusi.
Süsinikuühendi keemilised (ja osalt ka füüsikalised) omadused ja aineklassi määrab see, millised funktsionaalrühmad molekulis lisaks süsinikahelale leiduvad. Näiteks käituvad karboksüülrühma sisaldavad ühendid vesilahuses nõrkade hapetena. Kui asendada hapnikuga seotud vesinikuaatom karboksüülrühmas süsiniku aatomiga (näiteks –CH3 koostises), saame esterrühma, mida sisaldavad ühendid enam vesilahuses happelised ei ole. Oluliselt muutuvad ka aine lahustuvus, keemis- ja sulamistemperatuur jt füüsikalised omadused. Seetõttu on orgaanilises keemias väga oluline jälgida, kuidas on aatomid ühendi molekulis omavahel seotud, sest väike muutus struktuuris võib muuta palju aine omadusi.
Funktsionaalrühm on aatomite rühm molekulis, mis määrab selle keemilised omadused.
Joonis 1. Vasakpoolne ühend käitub vesilahuses happena, parempoolne mitte
6.2. Süsinikuühendite valemid
Summaarses valemis ehk molekulivalemis märgitakse koostiselementide aatomite arvud molekulis.
Orgaanilise molekuli koostist saab üles märkida erinevatel viisidel. Kõige lihtsam on koostist näidata summaarse valemi ehk molekulivalemi abil, milles märgitakse koostiselementide aatomite arvud molekulis. Kokkuleppeliselt kirjutatakse esimesena süsiniku aatomite arv ja teisena vesiniku aatomite arv. Ülejäänud elemendid järgnevad neile tähestiku järjekorras. Näiteks etanooli molekulivalem on C2H6O, glükoosi oma C6H12O6, 4-aminobutaanhappe ehk gamma-aminovõihappe (oluline aine närvisignaali ülekandes) molekulivalem aga C4H9NO2. Paraku annab selline aine koostise esitamise viis kõige vähem kasulikku informatsiooni, sest aine omadused määrab peamiselt molekuli struktuur. Kõige informatiivsemad on need molekuli kujutamise viisid, mis annavad edasi ka info selle kohta, kuidas erinevad aatomid on omavahel seotud. Seda võib teha molekulimudelitega.
Molekulimudel kujutab aatomite paiknemist molekulis.
Koolides levinud molekulimudelites kujutatakse sageli aatomeid eri suurusega kuulidena ning keemilisi sidemeid vardakestena, mis sobituvad kuulides olevatesse aukudesse. Selliste mudelite abil saab näidata, millised aatomid on molekulis omavahel ühendatud ja milline on molekuli kuju. Tegelikult keemiline side muidugi vardake ei ole ning kõige täpsemalt näitavad molekuli kuju täisruumilised molekulimudelid. Näiteks 4-aminobutaanhappe molekuli saab kujutada järgmiste molekulimudelitega:
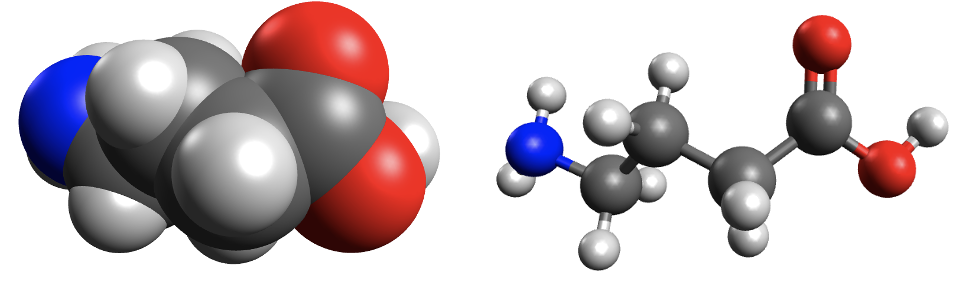
Joonis 1. 4-aminobutaanhappe täisruumiline ja kuul-varrasmudel
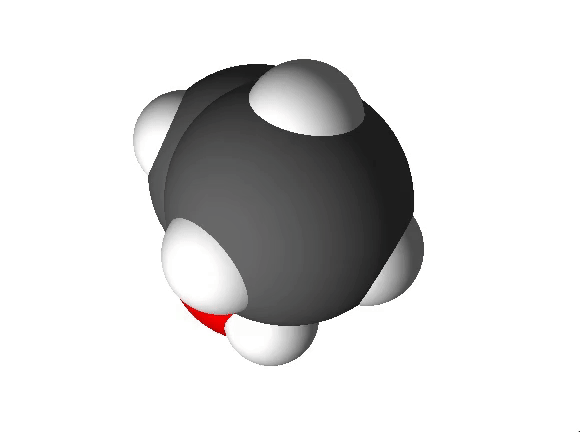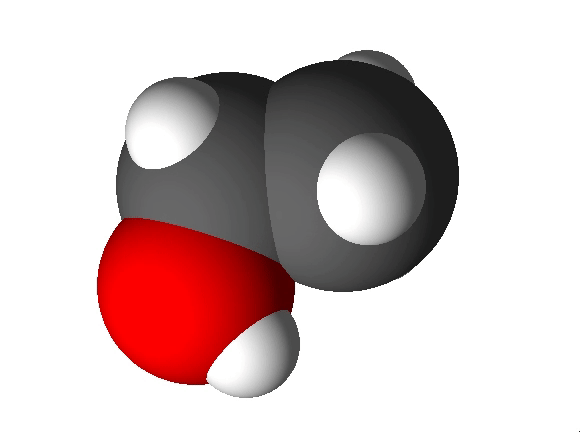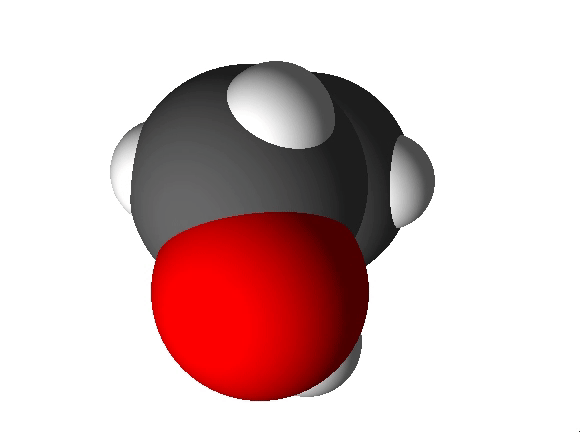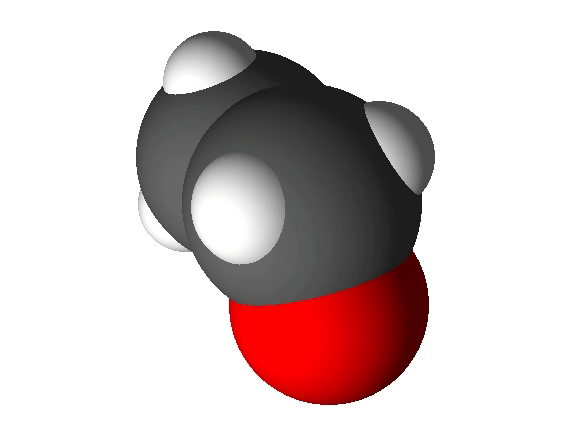
Joonis 2. Etanooli molekulimudel
Kuigi molekulimudelid kujutavad molekuli struktuuri kõige täpsemalt, vajab nende koostamine erilisi vahendeid (spetsiaalne arvutiprogramm või molekulimudelite komplekt) ja need on suuremate molekulide puhul raskesti jälgitavad. Praktikas kasutatakse seetõttu molekulide struktuuri üles märkimiseks tavaliselt struktuurivalemeid. Tasapinnalises ehk klassikalises struktuurivalemis märgitakse ühel tasapinnal kõik keemilised sidemed molekulis.
Tasapinnaline ehk klassikaline struktuurivalem näitab, millised aatomid on omavahel seotud ja millised sidemed nende vahel esinevad.
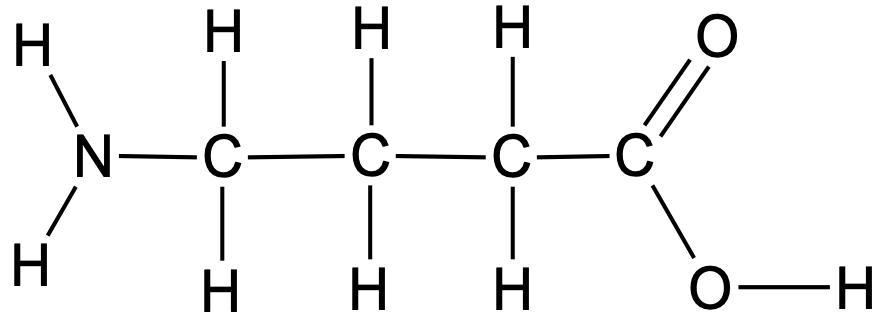
Joonis 3. 4-aminobutaanhappe tasapinnaline struktuurivalem
Tasapinnaline valem ei kujuta õigesti molekuli kuju, kuid näitab detailselt, kuidas on aatomid keemiliste sidemetega ühendatud. Paraku on suuremate molekulide tasapinnalised struktuurivalemid raskesti jälgitavad ja nende kirjutamine aeganõudev.
Lihtsustatud struktuurivalem on selline valem, kus esitatakse sidemetega seotud aatomite rühmad. Lihtsustatud struktuurivalemis jäetakse keemilised sidemed kas osaliselt või täielikult märkimata. 4-aminobutaanhapet võib lihtsustatud struktuurivalemiga üles märkida nagu joonisel 4, aga näiteks ka lihtsalt kui H2N–CH2–CH2–CH2–COOH (või H2NCH2CH2CH2COOH).
Lihtsustatud struktuurivalemis märgitakse sidemetega seotud aatomite rühmad.
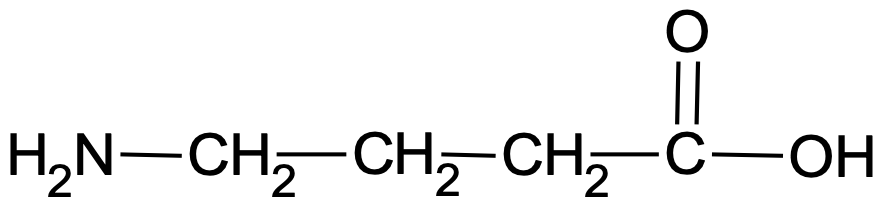
Joonis 4. 4-aminobutaanhappe lihtsustatud struktuurivalem
Suuremate molekulide kujutamiseks on kõige mugavam molekuli graafiline struktuurivalem ehk graafiline kujutis, milles näidatakse aatomitevahelisi sidemeid ja süsinikahela tasapinnalist kuju, ent üldiselt ei märgita C–H sidemeid ja süsinikuaatomiga seotud vesinikuaatomeid. Kriipsukesed kujutavad C–C sidemeid ja kriipsu murdekohas või otspunktis on süsinikuaatom. Süsinikuaatomiga seotud vesinikud tuleb ise juurde mõelda, kasutades teadaolevat süsinikuaatomi sidemete arvu ja muude sidemete arvu ühendis. 4-aminobutaanhappe graafiline kujutis on järgmine:
Graafiline struktuurivalem näitab ära süsinikahela paiknemise tasandil.
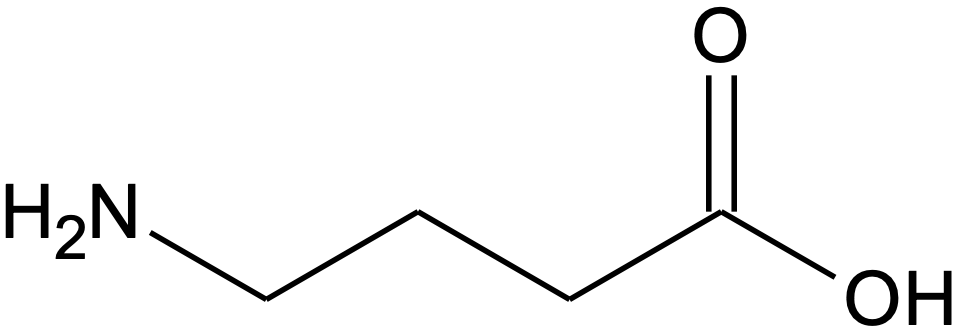
Joonis 5. 4-aminobutaanhappe graafiline kujutis
Selles valemis kujutavad kolm murdekohta, mille juurde pole muid aatomeid märgitud, süsinikuaatomeid süsinikahelas. Kuna süsiniku aatomil on neli sidet, peab murdekoha süsiniku aatomiga olema seotud kaks vesinikuaatomit ning iga murdekoht kujutab –CH2–. Hapnikuaatomitega seotud süsinikuaatomil ahela lõpus on juba neli sidet olemas, seega selle süsinikuaatomiga täiendavaid vesinikuaatomeid seotud ei ole. Graafiliste struktuurivalemite kasutamine on tänapäeval orgaanilises keemias kõige levinum viis molekule kujutada ning seega on väga oluline selgeks saada nende valemite kirjutamine ja lugemine. Vajadusel võta aega selle harjutamiseks.
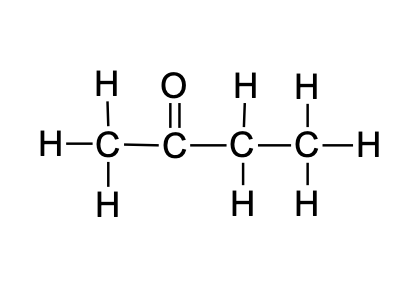
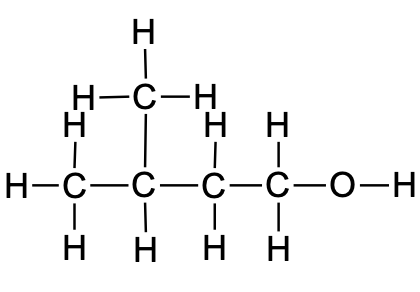
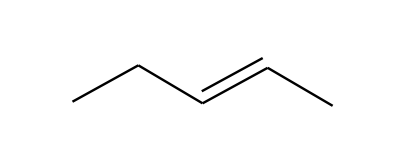
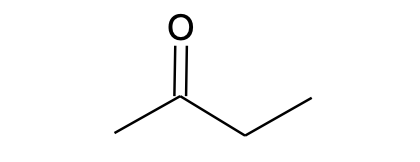
Tabel 1. Näited molekuli struktuuri erinevatest esitusviisidest
|
Molekulimudel |
|
|
|
|
Klassikaline struktuurivalem |
|
|
|
|
Lihtsustatud struktuurivalem |
CH3CH2CH=CHCH3 |
CH3COCH2CH3 |
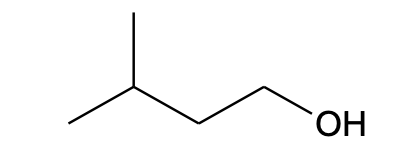
CH3CH(CH3)CH2CH2OH |
|
Graafiline kujutis |
|
|
|
|
Molekulivalem (summaarne valem) |
C5H10 |
C4H8O |
C5H12O |
Süsinikahelad
Süsinikahelad võivad olla sirged ehk lineaarsed, hargnenud või tsüklilised.
Orgaanilise molekuli n-ö skelett on peamiselt süsinikahel, aga võib sisaldada ka teisi aatomeid. Süsinikahelad võivad olla sirged ehk lineaarsed. Sellistes süsinikahelates paiknevad süsinikuaatomid järjestikku (ükski C-aatom ei ole seotud enam kui kahe teise C-aatomiga). Ruumilise kuju poolest on “sirge” ahel tegelikult küll pigem siksakiline, sest C–C sidemete vahel on umbes 109° nurgad. Hargnenud ahela korral on üks süsinikuaatom seotud kolme või nelja teise süsinikuaatomiga. Võimalikud on ka tsüklilised süsinikahelad.
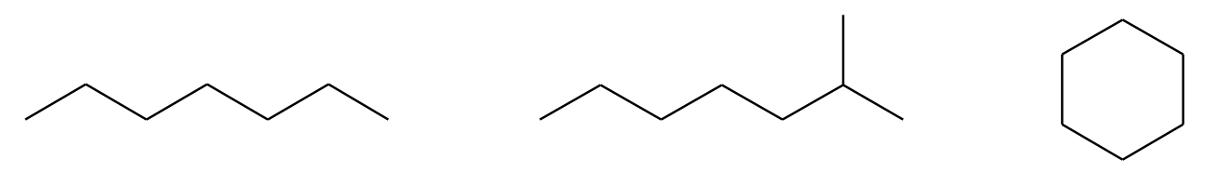
Joonis 6. Sirge (vasakul), hargnenud (keskel) ja tsüklilise (paremal) süsinikuahela näide
Isomeeria
Isomeerid on ained, millel on sama molekulivalem, kuid erinev molekuli struktuur.
Kuna molekuli struktuur määrab aine omadused, on isomeeridel erinevad omadused. Tuntakse erinevaid isomeeriatüüpe. Isomeerid võivad erineda näiteks funktsionaalrühma (funktsionaalrühma isomeeria), süsinikahela paigutuse (ahelaisomeeria) või funktsionaalrühma asendi poolest (asendiisomeeria).
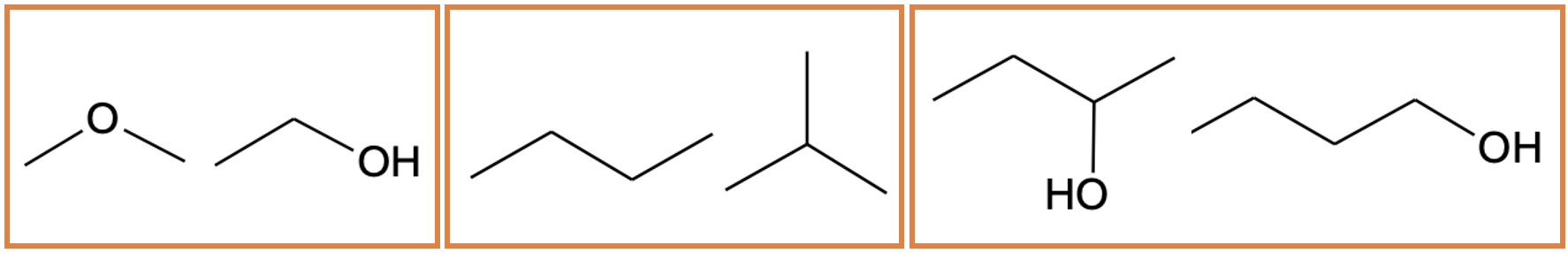
Joonis 7. C2H6O funktsionaalrühma isomeeride paar (vasakul), C4H10 ahelaisomeeride paar (keskel) ja C4H10O asendiisomeeride paar (paremal)
6.3. Oksüdatsiooniastme (o-a) määramine
Iga sideme korral väiksema elektronegatiivsusega aatomiga väheneb C o-a ühe võrra.
Iga sideme korral süsinikuaatomist suurema elektronegatiivsusega aatomiga suureneb C o-a ühe võrra.
Süsiniku oksüdatsiooniastmeid võib orgaanilistes ainetes leida iga süsinikuaatomi jaoks eraldi või arvutada süsiniku keskmine oksüdatsiooniaste molekulis. Süsinikuaatomi o-a leidmiseks tuleb vaadata, milliste aatomitega on süsinikuaatomil keemilised sidemed. Iga sideme korral väiksema elektronegatiivsusega aatomiga (vesinik) väheneb C o-a ühe võrra. Iga sideme korral süsiniku aatomist suurema elektronegatiivsusega aatomiga (hapnik, lämmastik, halogeenid) suureneb C o-a ühe võrra. Sidemed teiste süsinikuaatomitega C-aatomi oksüdatsiooniastet ei muuda.
Vesiniku o-a orgaanilistes ühendites on I, hapniku o-a enamasti –II ning halogeenide o-a –I.
Näide 1
Metanoolis CH3–OH on süsinikuaatomil kolm sidet vesinikuaatomitega ja üks side hapnikuaatomiga. Kokku saame C oksüdatsiooniastmeks –1∙3 + 1 = –2 (–II).
Näide 2
Diklorometaanis CH2Cl2 on süsinikuaatomil kaks sidet vesinikuaatomitega ja kaks sidet klooriaatomitega. Seega on C o-a –1∙2 + 1∙2 = 0.
Näide 3
Etanaalis CH3–CH=O on esimesel C-aatomil kolm sidet H-aatomitega ja üks side teise C-aatomiga, teisel C-aatomil on täiendavalt side H-aatomiga ja kaksikside O-aatomiga. Esimese C-aatomi o-a on seega –1∙3 = –3 (–III), teise C aatomi o-a –1 + 2 = +1 (I).
6.4. Alkaanid
Alkaanid on süsivesinikud, mille struktuuris esinevad ainult üksiksidemed.
Alkaanid on küllastunud süsivesinikud, mille struktuuris esinevad ainult üksiksidemed (st puuduvad kordsed sidemed). Alkaanid võivad olla nii sirge kui ka hargneva ahelaga. Lisaks võivad alkaanide molekulide ahelad moodustada tsükleid (tsükloalkaane). Alkaane kutsutakse "küllastunud süsivesinikeks" seetõttu, et need ei ole võimelised osalema liitumisreaktsioonides. Alkaanide, nende omaduste, nimetamise ja isomeeridega saad tutvuda järgnevas videos.
Allikas: https://youtu.be/F27sXv0K2Oo
Alkaanide nimetamine
Alkaanide nimetamisel kasutatakse järelliidet -aan. On väga oluline õppida pähe esimese kümne sirge ahelaga alkaani nimetused, sest nendel põhineb suurel määral ka teistesse aineklassidesse kuuluvate orgaaniliste ühendite nimetamine. Sirge ahelaga alkaanide nimetuste õppimise muudab lihtsamaks see, et alates viiesüsinikulistest ahelatest lähtub alkaani nimetus lihtsalt süsinike arvu märkivast tüvest (analoogiliselt eesliidetele oksiidide nimetamisel), mille lõppu on lisatud -aan.
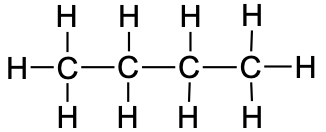
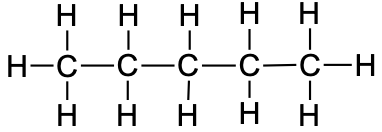
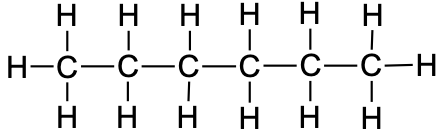
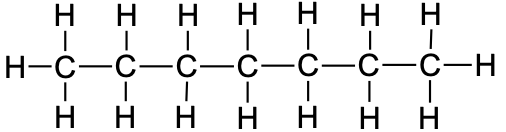
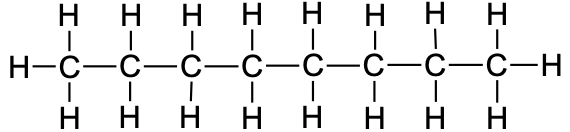
Tabel 1. Sirge ahelaga alkaanide nimetused
|
C arv |
Nimetus |
Tasapinnaline |
Lihtsustatud |
Summaarne valem |
|
1 |
metaan |
|
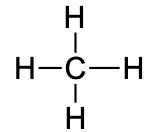
CH4 |
CH4 |
|
2 |
etaan |
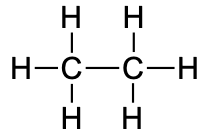
|
CH3CH3 |
C2H6 |
|
3 |
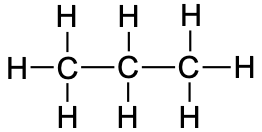
propaan |
|
CH3CH2CH3 |
C3H8 |
|
4 |
butaan |
|
CH3CH2CH2CH3 |
C4H10 |
|
5 |
pentaan |
|
CH3CH2CH2CH2CH3 |
C5H12 |
|
6 |
heksaan |
|
CH3CH2CH2CH2CH2CH3 |
C6H14 |
|
7 |
heptaan |
|
CH3CH2CH2CH2CH2CH2CH3 |
C7H16 |
|
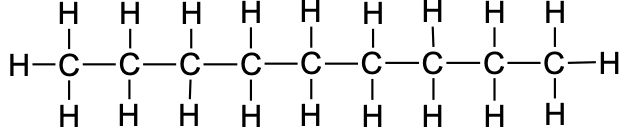
8 |
oktaan |
|
CH3CH2CH2CH2CH2CH2CH2CH3 |
C8H18 |
|
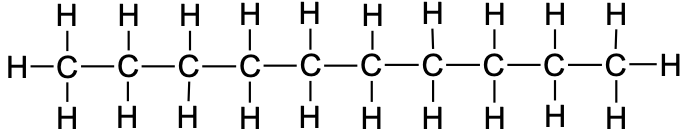
9 |
nonaan |
|
CH3CH2CH2CH2CH2CH2CH2CH2CH3 |
C9H20 |
|
10 |
dekaan |
|
CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 |
C10H22 |
Hargnenud ahelaga alkaanide nimetamisel tuleb molekuli kõige pikemale süsinikahelale vastava alkaani nimetus võtta tüviühendi nimetuseks, mille ette kirjutatakse asendusrühmade (põhiahelast hargnevate külgahelate) asukohta põhiahela suhtes märkivad numbrid ja rühmade nimetused. Põhiahela süsinikuaatomid peab nummerdama nii, et rühmade asendeid kirjeldavad numbrid tuleksid võimalikult väikesed.
Rühma nimetus on sarnane vastava alkaani nimetusele, ainult -aan liite asemel on -üül: metüül, etüül, propüül jne.
Asukoha nr + (vajadusel eesliide) + rühma nimetus + tüviühendi nimetus.
Kui ühesuguseid rühmi on mitu, siis kasutatakse nende arvu märkimiseks kreeka keelest pärit eesliidet.
- Mono - üks
- Di - kaks
- Tri – kolm
- Tetra – neli
- Penta – viis
- Heksa – kuus
- Hepta – seitse
- Okta – kaheksa
- Nona – üheksa
- Deka – kümme
Praktikas jäetakse eesliide "mono" enamasti ära.
Kui erinevat tüüpi asendusrühmi on mitu, siis märgitakse need tähestiku järjekorras (koos vastavate asukohanumbrite ja eesliidetega) tüviühendi ette. Seetõttu märgitakse alkaani nimetuses näiteks etüülrühm enne metüülrühma.
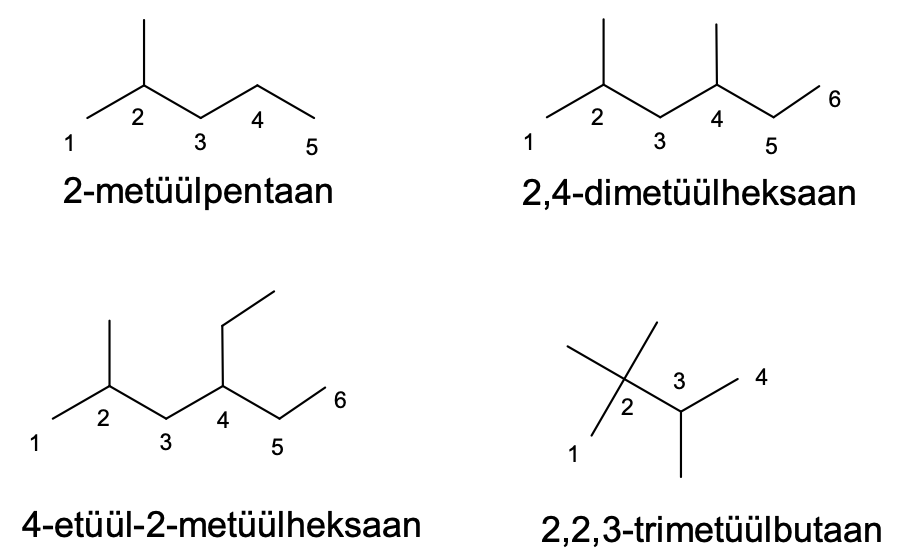
Joonis 1. Näiteid hargnenud alkaanide nimetamisest
Alkaanide füüsikalised omadused
Alkaanide füüsikalised omadused sõltuvad molekulide suurusest.
Kõigi ainete, ka alkaanide puhul kasvavad molekuli suuruse kasvuga ka molekulidevahelised jõud, mistõttu tõuseb ainete keemistemperatuur. Ühe- kuni neljasüsinikulised alkaanid on toatemperatuuril gaasid. Kui süsinikuaatomite arv alkaanis on 5–18, on nad enamasti vedelikud, suurema molekuliga alkaanid on tahked ained. Alkaanide sulamis- ja keemistemperatuurid sõltuvad ka nende ahelate kujust. Sirge ahelaga alkaanide sulamis- ja keemistemperatuurid on üldreeglina kõrgemad kui sama C- ja H-aatomite arvuga hargnenud alkaanidel. Mida hargnenum on alkaani struktuur, seda madalam on üldiselt tema sulamis- ja keemistemperatuur. Sirge ahelaga alkaanid paigutuvad paremini üksteise kõrvale ja omavad suuremat efektiivset kokkupuutepinda kui hargnenud ahelaga alkaanid. Seetõttu mõjuvad sirge ahelaga alkaanimolekulide vahel ka tugevamad molekulidevahelised jõud.
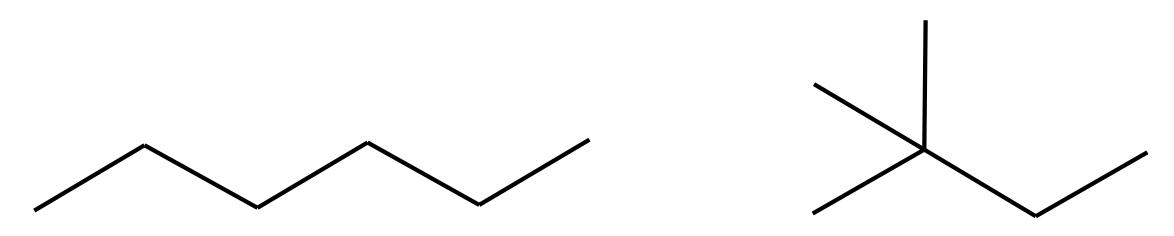
Joonis 2. Heksaani (vasakul) keemistemperatuur on 69 °C, 2,2-dimetüülbutaani (paremal) keemistemperatuur on aga 50 °C. Kuigi nende ühendite molekulivalem on sama, on 2,2-dimetüülbutaani molekulid kerakujulisemad ja neid ei saa nii efektiivselt üksteise kõrvale paigutada kui sirge ahelaga molekule, mistõttu on molekulidevahelised jõud nõrgemad
Alkaanid on mittepolaarsed ja hüdrofoobsed ühendid, mis ei anna vesiniksidemeid.
Alkaanid on mittepolaarsed ühendid, sest sisaldavad ainult praktiliselt mittepolaarseid C–H sidemeid ega saa moodustada vesiniksidemeid. Seetõttu lahustuvad alkaanid polaarsetes lahustites halvasti ja on vees praktiliselt mittelahustuvad. Alkaanid on hüdrofoobsed ehk vett-tõrjuvad ained. Vedelad ja tahked alkaanid on veest kergemad (väiksema tihedusega) ained.
Alkaanide keemilised omadused
Alkaanid on väga inertsed ning tavatingimustes ei reageeri praktiliselt millegagi. Kõrgemal temperatuuril alkaanid süttivad ning reageerivad hapnikuga ehk põlevad. Alkaanide põlemine on üks tähtsamaid reaktsioone, mille saadusteks on vesi ja süsihappegaas (täieliku põlemise korral ehk piisaval hapniku ligipääsul). Alkaanide põlemise käigus vabaneb palju ka energiat ning seetõttu kasutatakse alkaane kütusena. Näiteks propaan põleb järgneva võrrandi kohaselt:
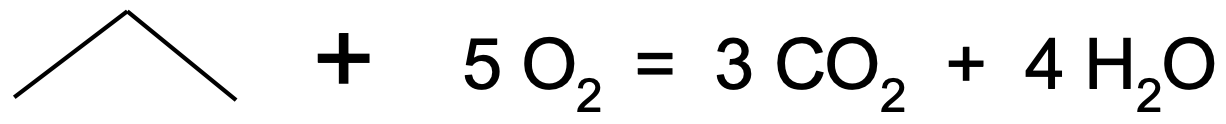
Joonis 3. Propaani põlemine
Mugavam on sama reaktsiooni väljendada propaani molekulivalemit kasutades:
C3H8 + 5O2 → 3CO2 + 4H2O
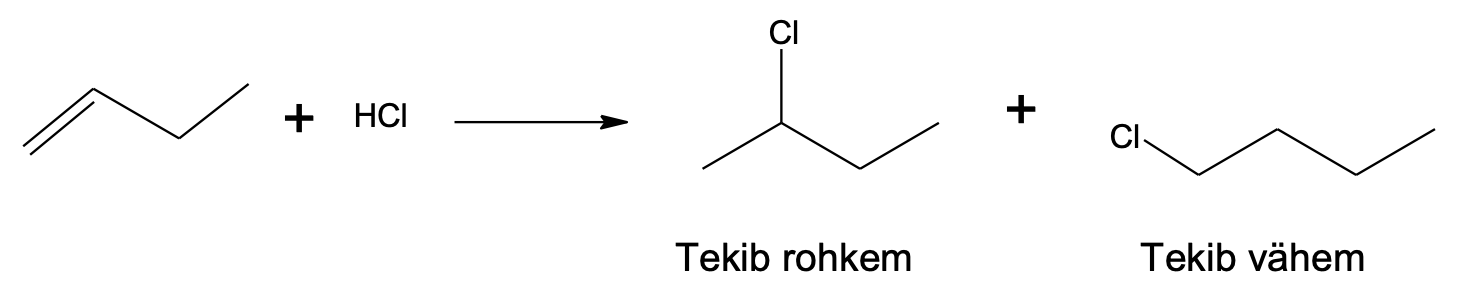
Alkaanidele on iseloomulikud asendusreaktsioonid halogeenidega. Asendusreaktsioon on reaktsioon, mille käigus molekulis asendatakse mingi aatom (või aatomite rühm) teise aatomi (või aatomite rühmaga). Need reaktsioonid on tööstuses väga olulised, sest võimaldavad saada alkaanidest reaktsioonivõimelisemaid ühendeid.
Alkaanidele on iseloomulikud asendusreaktsioonid.
Asendusreaktsioon halogeeniga vajab esmalt halogeenimolekulide lagundamist aatomiteks, mis on radikaalid – paardumata elektroniga osakesed. Reaktsiooni saadusteks on halogenoalkaan, kus üks või mitu vesinikku alkaanis on asendunud halogeeniaatomiga, ning vesinikhalogeniid. Mida hargnenum on süsinikahel C–H sideme juures, seda kiiremini sideme H-aatom halogeenimisreaktsioonis asendub. Samas pole need reaktsioonid väga selektiivsed ja seetõttu tekib sageli erinevate halogeeniühendite segu.
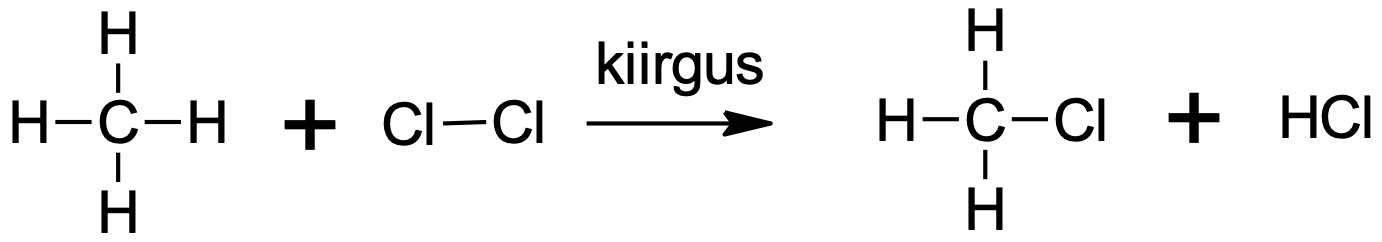
Joonis 4. Metaani kloorimine on lihtne näide alkaani halogeenimisest. Esimeses etapis tekib klorometaan
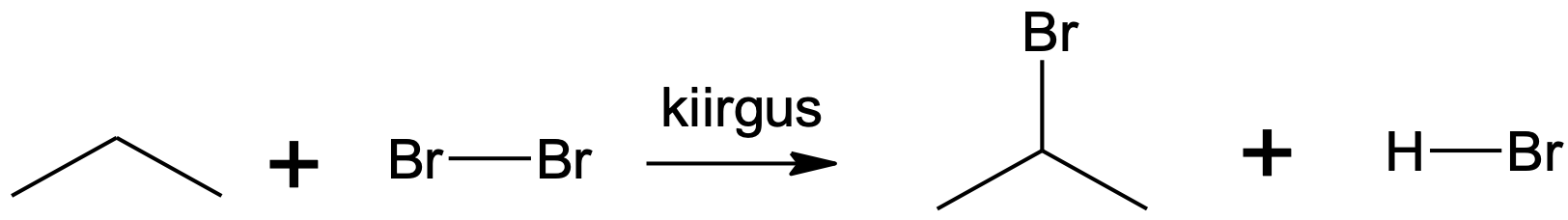
Joonis 5. Propaani broomimine
 Loe lisaks: Radikaalreaktsioonid.
Loe lisaks: Radikaalreaktsioonid.
Side halogeeniaatomite vahel on küllaltki nõrk ja selle lõhkumiseks on vaja suhteliselt vähe energiat. Seetõttu võib Hal-Hal side katkeda UV-kiirguse või kõrge temperatuuri mõjul:
Cl2 $\xrightarrow{UV-kiirgus}$ 2 Cl∙
Kuna halogeeniaatomid tõmbavad kovalentse sideme elektrone enda poole võrdselt, jääb kovalentse sideme katkemisel antud juhul kummalegi halogeeniaatomile üks paardumata elektron, mida märgime võrrandis punktikesega. Moodustub radikaal, mis on väga reaktsioonivõimeline, sest halogeeniaatom soovib saavutada elektronoktetti, kuid radikaalil on väliskihis ainult 7 elektroni. Halogeeniaatom võib võtta elektronokteti saavutamiseks omakorda süsivesinikult vesinikuaatomi:
Cl∙ + CH4 → HCl + ∙CH3
Kuid selle käigus jääb paardumata elektron süsinikule ja süsivesinikust moodustub uus radikaal. Tekkinud radikaal võib analoogiliselt edasi reageerida:
∙CH3 + Cl2 → CH3Cl + Cl∙
Nagu näeme, toimub radikaaliline asendus ahelreaktsioonina: ühest radikaalist tekib reaktsiooni käigus teine radikaal ning reaktsiooniahel võib veel pikalt jätkuda. Ahel saab katkeda siis, kui kokku satuvad kaks radikaali, mille paardumata elektronid saavad moodustada püsiva sideme:
2 Cl∙ → Cl2
Cl∙ + ∙CH3 → CH3Cl
2 ∙CH3 → CH3CH3
Alkaani asendusreaktsioon halogeeniga on ainult üks näide radikaalreaktsioonist. Radikaalreaktsioonide hulka kuuluvad näiteks ka süsivesinike põlemisprotsessid ning mitmed polümerisatsioonireaktsioonid. Ka osoonikihi hõrenemist põhjustavad teatud halogeeniühendite (freoonide) lagunemisel eralduvad klooriradikaalid, mille teket põhjustab kõrgemal atmosfääris esinev intensiivne UV-kiirgus. Radikaalid tekivad samuti elusolendites ning osalevad organismile olulistes bioloogilistes protsessides, kuid võivad ka rakke kahjustada.
Alkaanide kasutamine
Kergemad (lühema ahelaga) gaasilised alkaanid leiavad kasutust kütusena kodudes, liikluses ning tööstuses. Metaani (CH4) tuntakse ka maagaasi nime all. Tavaline balloonigaas on propaani ja butaani segu (kolme- ja neljasüsinikulised alkaanid), mis rõhu all on vedelik, kuid rõhu alanedes aurustub kergesti. Erinevatest vedelatest alkaanidest koosnevad naftast saadud vedelkütused nagu bensiin ja diislikütus, aga ka mõned lahustid. Siiski on oluline meeles pidada, et bensiini ja diislikütuse koostises võib olla lisaks alkaanidele ka teiste aineklasside esindajaid. Pikkade ahelatega alkaane, mis on tahked, kohtame näiteks parafiini koostises. Parafiini levinuim kasutusala on olnud küünalde valmistamine. Veelgi pikemate süsinikuahelatega alkaane leidub polümeerides, kus ahelates võib olla isegi enam kui sada tuhat süsinikuaatomit. Alkaanide hulka kuuluvatest polümeeridest kõige levinumad on polüetüleen (polüeteen) ja polüpropüleen (polüpropeen), millest valmib suur osa igapäevases kasutuses olevatest kiledest ja plastikust
6.5. Halogeeniühendid
Halogeeniühendid on ained, kus orgaanilise molekuli üks või mitu C–H vesinikku on asendatud halogeeniaatomiga. Alkaanidest lähtuvad halogeeniühendid on asendatud alkaanid. Neis ainetes esineb halogeeni ja süsiniku aatomite vahel side C–Hal. Halogeeniühendis võib sisalduda nii fluor (F), kloor (Cl), broom (Br) kui ka jood (I). Halogeeniühendite kohta vaata lähemalt järgmisest videost.
Allikas: https://youtu.be/ng1t_qpFhWA
Halogeeniühendite nimetamine
Halogeeniühendite nimetamine meenutab hargnenud alkaanide nimetamist, kus halogeenile vastavat rühma nimetatakse nagu külgrühma. Halogeeniühendite korral kasutatakse enamasti nendele vastavaid eesliiteid:
- F – fluoro
- Cl – kloro
- Br – bromo
- I – jodo
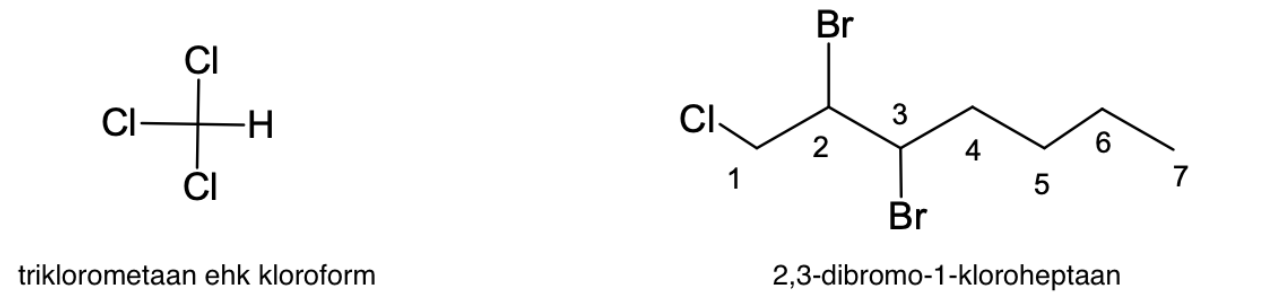
Joonis 1. Näiteid alküülhalogeniididest
Kasutusel on ka teine nimetamise viis, kus halogeenile vastavat rühma kasutatakse järelliitena (fluoriid, kloriid, bromiid, jodiid) ja alkaanile vastavat rühma eesliitena. Näiteks CH3–Cl võib nimetada nii klorometaaniks (eelistatud nimetus) kui ka metüülkloriidiks.
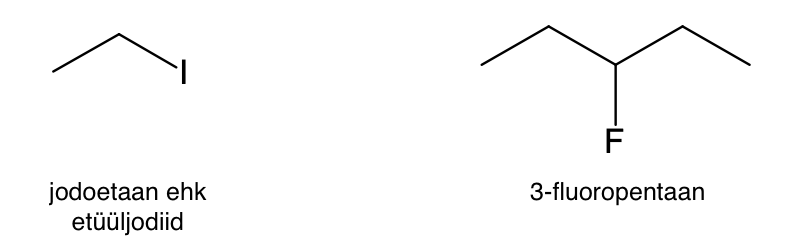
Joonis 2. Lihtsa struktuuriga jodoetaani võib nimetada ka etüüljodiidiks (halogeen märgitud järelliitena), kuid keerukama struktuuriga 3-fluoropentaani puhul ei ole halogeeni märkimine järelliitena mõttekas
Halogeeniühendite omadused ja kasutamine
Halogeeniühendid on hüdrofoobsed.
Kuigi halogeeniühendid on alkaanidest polaarsemad, ei anna halogeeniühendid üldiselt vesiniksidemeid, on hüdrofoobsed ning lahustuvad vees väga vähe. Halogeeniühendite keemistemperatuurid sarnanevad sama suurte molekulidega alkaanide keemistemperatuuridele, kuid on neist veidi kõrgemad, sest halogeeniühendite molekulide vahel mõjuvad veidi tugevamad molekulidevahelised jõud. Halogeeniühendid on keemiliselt reaktsioonivõimelisemad kui alkaanid ning neid kasutatakse laialdaselt orgaanilises sünteesis.
Tabel 2. Halogeeniühendite keemistemperatuurid
|
Aine |
CH3Cl |
CH3CH2Cl |
CH3CH2CH2Cl |
CH3CH2CH2CH2Cl |
|
Keemistemperatuur, °C |
–24 |
12 |
47 |
78 |
Alates 19. saj on halogeeniühendeid tuntud anesteetikumidena, külmikutes on kasutatud freoone (kloori ja fluori aatomeid sisaldavad ühendid). Tänapäeval on halogeeniühendid ka näiteks mitmete ravimite ja taimekaitsevahendite koostises. Laialdaselt on kasutusel polüvinüülkloriid ehk PVC, millest valmistatakse pakkekilesid, torusid ja muid tooteid. Halogeeniühendite kasutamisega on seotud ka mitmed keskkonnaprobleemid (osoonikihi hõrenemine freoonide tõttu, bioakumuleeruvad orgaanilised saasteained) ning sageli püütakse halogeeniühendeid asendada teiste, keskkonnasõbralikumate ühenditega.
 Loe lisaks: Nukleofiilne asendusreaktsioon
Loe lisaks: Nukleofiilne asendusreaktsioon
Halogeeniühenditega toimuvad nukleofiilsed asendusreaktsioonid, kus halogeeniaatom asendatakse mõne teise rühmaga. Need reaktsioonid muudavad halogeeniühendid olulisteks lähteaineteks paljude ainete saamisel.

Näide halogeeniühendi reaktsioonist
Nukleofiil on negatiivse laengu (või osalaengu) ja kõrge energiaga elektronipaariga osake. Nukleofiilil on elektrone n-ö üle ja ta tahab keemilises reaktsioonis oma elektronid uude sidemesse loovutada. Nukleofiil võib olla hüdroksiidioon, halogeniidioon, happeanioon vms. Nukleofiilne tsenter on üldiselt negatiivse laengu (või osalaenguga) aatom nukleofiilis.
Elektrofiil on positiivse laengu või osalaenguga osake, millel on n-ö elektronide puudujääk. Elektrofiilne tsenter on positiivse laengu või osalaenguga aatom elektrofiilis.
Näites toodud asendusreaktsioonis on nukleofiil OH–. C–Br sideme juures on süsinikul väike positiivne osalaeng, mistõttu on see elektrofiilne tsenter ja bromopropaan käitub elektrofiilina. Reaktsiooni käigus asendab OH– broomi aatomi, mis eraldub bromiidioonina. Naatriumioonid tegelikult reaktsioonist osa ei võta. Nukleofiilses asendusreaktsioonis on ründav osake alati nukleofiil ja reaktsioon toimub elektrofiilse tsentri juures.
Põhjalikumalt võid nukleofiilse asendusreaktsiooni kohta vaadata järgmisest videost: https://youtu.be/e4dQvJMiTQI
6.6. Küllastumata ühendid: alkeenid ja alküünid
Alkeenid ja alküünid on küllastumata ühendid. Küllastumata ühendid sisaldavad kordseid sidemeid: alkeenide aineklassi korral leidub ühendis süsinikuaatomite vahel kaksikside ning alküünide aineklassi korral kolmikside.
Alkeenid ja alküünid on süsivesinikud, mis sisaldavad kordseid sidemeid.
Mõiste "küllastumata ühendid" viitab sellele, et need ühendid saavad anda liitumisreaktsioone, samas kui küllastunud süsivesinikud saavad anda ainult asendusreaktsioone. Küllastumata ühenditega saad lähemalt tutvuda järgmises videos.
Allikas: https://youtu.be/4x0B9y-Eux4
Küllastumata süsivesinike nimetamine
Küllastumata süsivesinike nimetamine on sarnane alkaanide nimetamisega. Alkaani järelliite –aan asemel tuleb alkeenide korral kasutada järelliidet –een ning alküünide korral järelliidet –üün. Lisaks tuleb numbriliselt ka ära näidata, mitmenda süsiniku aatomi juures peaahelas vastav kordne side asetseb.
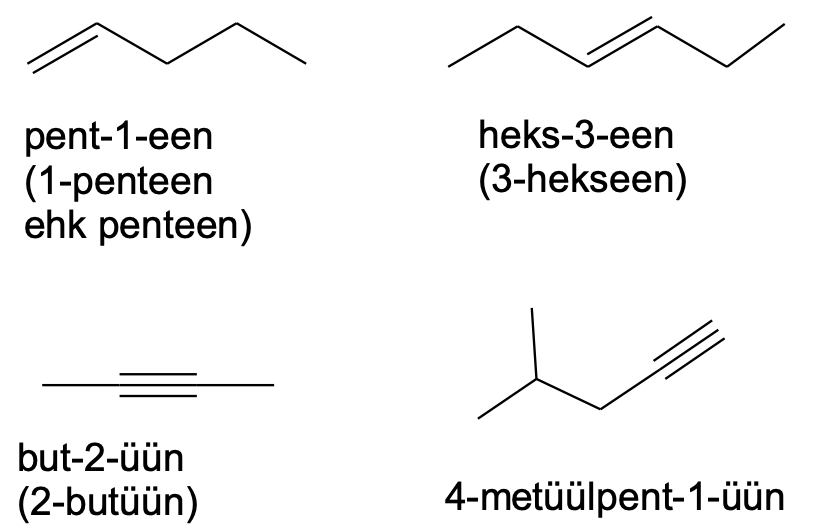
Kui samasuguseid kordseid sidemeid on ühendis mitu, siis tuleb kasutada vastavat eesliidet (di-, tri-, tetra-) jne. Sama pikkade ahelate korral tuleks peaahelaks valida see, mille sisse jäävad ka kordsed sidemed. Muul juhul tuleks valida pikim süsinikahel.
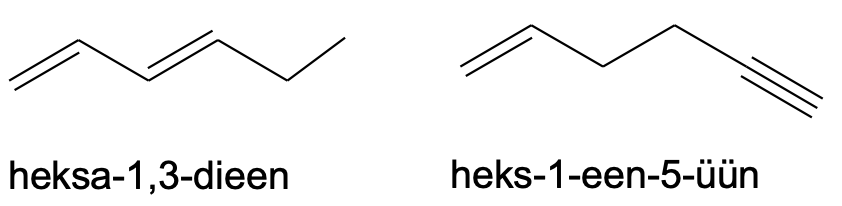
Pane tähele, et kuna näiteks „heksdieeni“ oleks ebamugav välja hääldada, nimetatakse selle asemel ühendit „heksadieeniks“.
Cis-trans isomeeria
C–C üksiksidemega seotud aatomite rühmi saab hõlpsasti teineteise suhtes pöörata (selles on lihtne veenduda näiteks molekulimudelite komplekti abil). Toatemperatuuril piisab soojusenergiast, et aatomite rühmad üksiksidemete ümber pöörleksid, seetõttu kujutavad nt järgnevad butaani kirjutuskujud sama molekuli eri võimalikke “asendeid”:
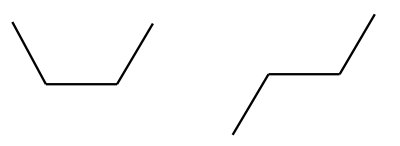
Reaalses butaanis leidub molekule, mis on igasugustes võimalikes asendites. Kuna pöörlemine ümber üksiksideme toimub väga kiiresti, siis tavatingimustes neid eri asendites molekule eraldada ei saa.
Kaksiksidemega seotud aatomite rühmi pöörata ei saa.
Kaksiksidemega seotud aatomite rühmi pöörata ei saa, sest selleks oleks vaja kaksikside ära lõhkuda (ka selles saab veenduda molekulimudelite komplekti abil). Seetõttu on kaksiksideme ümber paiknevad rühmad fikseeritud ja alkeenide korral esineb isomeeria liik, mida kutsutakse cis-trans isomeeriaks. Kui süsinikku sisaldavad rühmad on samal pool kaksiksidet, siis kutsutakse isomeeri cis-vormiks, ja kui vastavad rühmad on kaksiksideme eri pooltel, siis kutsutakse isomeeri trans-vormiks. Näteks but-2-eeni cis- ja trans-isomeerid on järgmised:

Alkeenide ja alküünide keemilised omadused
Alkeenidele ja alküünidele on iseloomulikud liitumisreaktsioonid.
Alkeenid ja alküünid on reaktsioonivõimelisemad kui alkaanid. Alkeenidele ja alküünidele on iseloomulikud liitumisreaktsioonid halogeeni (Hal2), vesinikhalogeniidi (H–Hal), vee (H2O) ja vesinikuga (H2). Kõigis nendes reaktsioonides liitub vastav aine alkeeni või alküüni kordsele süsinik-süsiniksidemele ning selle tulemusel sideme kordsus väheneb (kaksiksidemest saab üksikside ja kolmiksidemest kaksikside).
Alkeeni halogeenimisel tekib ainult dihalogenoühend. Vesinikhalogeniidi ei eraldu.
Alkeeni halogeenimine toimub oluliselt kergemini kui alkaani halogeenimine (alkaani halogeenimiseks on reeglina vajalik kõrge temperatuur või UV-kiirgus). Näiteks liitub broom alkeeniga kergesti juba toatemperatuuril ja pimedas, mistõttu broomivesi kaotab alkeenile lisades oma iseloomuliku punakaspruuni värvuse. Alkaaniga broom aga toatemperatuuril ja valgustamata ei reageeri, mistõttu saab broomivee abil eristada alkaani ja alkeeni. Pane tähele, et kuna alkeeni halogeenimine on liitumisreaktsioon, siis alkeeni halogeenimisel ei eraldu vesinikhalogeniidi (erinevalt alkaani halogeenimisest, mis on asendusreaktsioon). Alkeeni halogeenimisel lisandub mõlema C=C süsiniku aatomi juurde halogeeni aatom ja C=C (kaksik)side asendub selle käigus C–C (üksik)sidemega.
CH3–CH=CH–CH3 + Cl–Cl → CH3–CHCl–CHCl–CH3
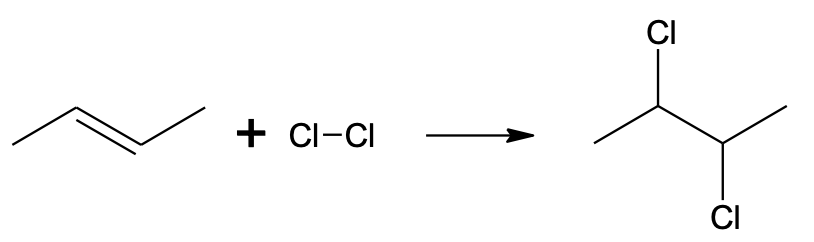
Kloori liitumine but-2-eenile
Kui viia kokku alkeen ja vesinikhalogeniidi lahus, liitub vesinikhalogeniid kergesti alkeeniga. Selle reaktsiooni käigus lisandub halogeeni aatom ühe C=C aatomi juurde, vesiniku aatom teise C=C aatomi juurde ja süsinikevaheline kaksikside asendub üksiksidemega.
CH3–CH=CH–CH3 + H–Br → CH3–CHBr–CH2–CH3
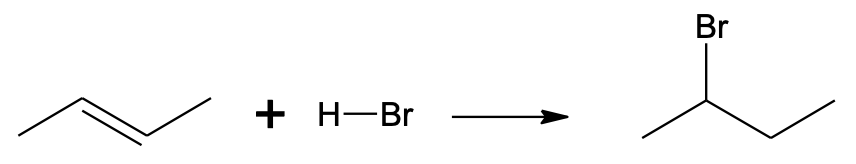
Vesinikhalogeniidi liitumine but-2-eenile
Alkeeni hüdraatimisel (vee liitumisel alkeenile) tekib alkohol.
Alkeeni hüdraatimine toimub katalüsaatori abil, milleks sobib hape (nt H2SO4). Selles reaktsioonis liitub ühe C=C aatomi juurde veest pärinev –OH, teise juurde veest pärinev –H aatom.
CH3–CH=CH–CH3 + H2O $\xrightarrow[]{hape}$ CH3–CHOH–CH2–CH3
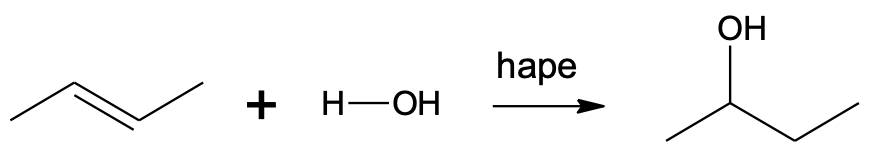
Vee liitumine but-2-eenile
Alkeeni hüdrogeenimisel tekib alkaan.
Alkeeni hüdrogeenimine vajab samuti katalüsaatorit (teatud siirdemetallid, nt Ni, Pd või Pt). Reaktsiooni toimumiseks võib olla vajalik ka kõrgendatud rõhk või temperatuur. Hüdrogeenimisel kaovad süsinikevahelised kordsed sidemed ja moodustub vastav küllastunud süsivesinik (alkaan).
CH3–CH=CH–CH3 + H2 $\xrightarrow[]{Pt}$ CH3–CH2–CH2–CH3

Vesiniku liitumine but-2-eenile
Liitumisreaktsioon kolmiksidemele toimub mitmes etapis. Esimeses etapis tekib kaksikside. Teises etapis toimub liitumine kaksiksidemele ning tulemuseks on C–C üksiksidemega saadus.
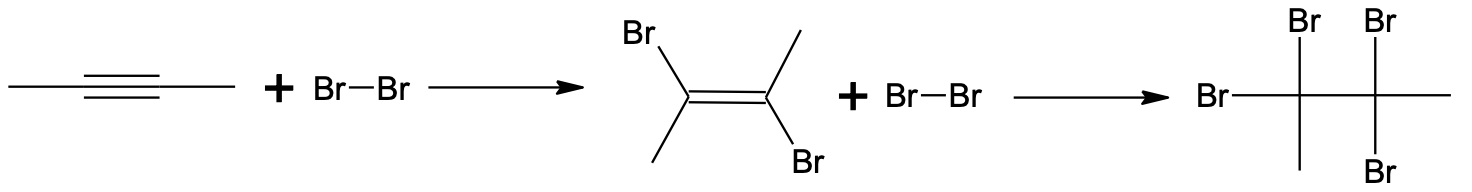
Broomi liitumine but-2-üünile
Vee või vesinikhalogeniidi liitumisel kaksiksidemele kehtib Markovnikovi reegel, mis väidab, et vesinikuaatom liitub süsinikuaatomiga, millega on seotud rohkem vesinikuaatomeid, ja –OH või halogeeni aatom liitub süsinikuaatomiga, millega on seotud vähem vesinikuaatomeid.
 Loe lisaks: Miks kehtib Markovnikovi reegel?Vee või vesinikhalogeniidi liitumine kaksiksidemele toimub mitmes etapis. Kaksikside käitub nukleofiilse tsentrina, millele liitub elektrofiil – vesinikioon. Tekkiv katioonne vaheühend (karbokatioon) käitub aga elektrofiilse tsentrina, millega reageerib nukleofiil – vastavalt vee molekul või halogeniidioon.
Loe lisaks: Miks kehtib Markovnikovi reegel?Vee või vesinikhalogeniidi liitumine kaksiksidemele toimub mitmes etapis. Kaksikside käitub nukleofiilse tsentrina, millele liitub elektrofiil – vesinikioon. Tekkiv katioonne vaheühend (karbokatioon) käitub aga elektrofiilse tsentrina, millega reageerib nukleofiil – vastavalt vee molekul või halogeniidioon.
Vaatleme vesinikkloriidi liitumist but-1-eenile. Algselt liitub but-1-eeniga vesinikkloriidist pärinev H+-ioon, mis võib liituda kaksiksideme otsmise või keskmise süsiniku aatomi juurde. Kui H+-ioon liitub otsmise süsiniku juurde, kus on rohkem vesiniku aatomeid, jääb positiivne laeng keskmise süsiniku juurde ahelas.
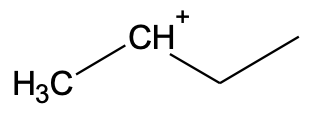
Kui H+-ioon liitub keskmise süsiniku juurde, kus on vähem vesiniku aatomeid, jääb positiivne laeng otsmise süsiniku juurde. Selline vaheühend on oluliselt ebastabiilsem.
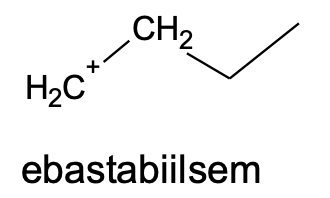
Reaktsioon toimub eelistatult stabiilsema vaheühendi kaudu, kus katioonse tsentri juures on vähem vesinikke:
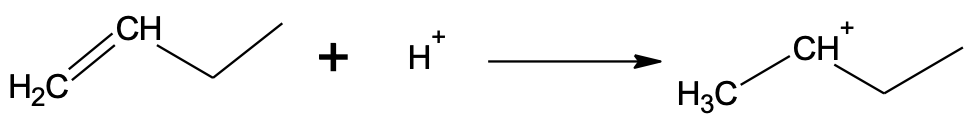
Algsest vesinikkloriidist on järele jäänud kloriidioon, mis käitub nukleofiilina. Kloriidioon saab liituda ainult elektrofiilse tsentriga ehk positiivse laenguga süsinikuga. Seetõttu toimubki kloriidiooni liitumine peamiselt keskmise süsiniku juurde.
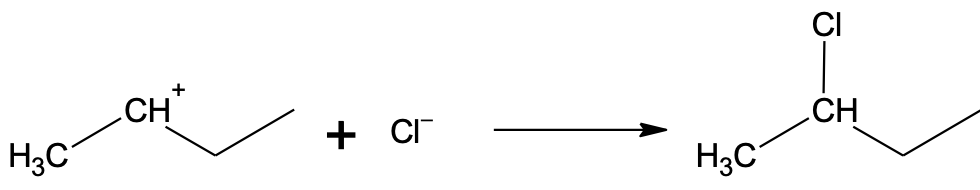
6.7. Aromaatsed ühendid
Aromaatsed ühendid sisaldavad küll kordseid süsinik-süsiniksidemeid, kuid on keemiliselt stabiilsemad kui alkeenid või alküünid. Aromaatsete ühenditega võid tutvuda järgmises videos.
Allikas: https://youtu.be/hmmGmz5CszU
Kõige tuntum aromaatne ühend on benseen C6H6, mis on magusa lõhnaga värvitu mürgine vedelik. Benseenimolekulil on kuusnurkne tasapinnaline struktuur, mille tippudes paiknevad süsinikuaatomid. Benseenitsükli struktuuri (ja ka teiste aromaatsete süsivesinike struktuuri) on klassikaliselt kujutatud vaheldumisi paiknevate süsinikevaheliste üksik- ja kaksiksidemete abil. Tegelikult on benseenis aga kõik süsinik-süsiniksidemed üksik- ja kaksiksidemete vahepealsed, n-ö pooleteistkordsed sidemed. Seda sidemete paiknemist võib märkida ka benseeni kuusnurga sisse joonistatud ringi või punktiirjoonega. Kõik need erinevad kujutamisviisid tähistavad aga muidugi ühte ja sama molekuli. Benseeni ja teiste aromaatsete ühendite tsükleid nimetatakse ka aromaatseteks tuumadeks või ringideks.
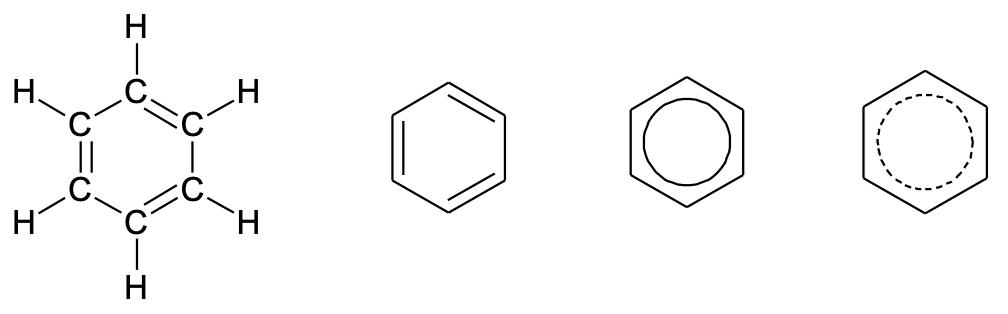
Joonis 1. Benseeni kujutamise viise
Aromaatsetes ainetes võib olla ka mitu tsüklit. Näiteks on aromaatsed naftaleen ja antratseen. Kõigile aromaatsetele tsüklitele on omane tasapinnaline kuju ja seetõttu ei ole aromaatsetes tsüklites tetraeedrilisi (nelja üksiksidemega) süsinikke. Ka grafeen (leht grafiidi struktuuris) on aromaatne struktuur. Kuna aromaatsus muudab aineid stabiilsemaks, on aromaatset tuuma sisaldavad ained looduses üsna levinud. Samuti sisaldavad aromaatset tuuma mitmed ravimid (nt aspiriin, paratsetamool ja ibuprofeen). Süsiniku asemel võib aromaatses tuumas olla ka teisi elemente nagu näiteks lämmastik (nt püridiinis).
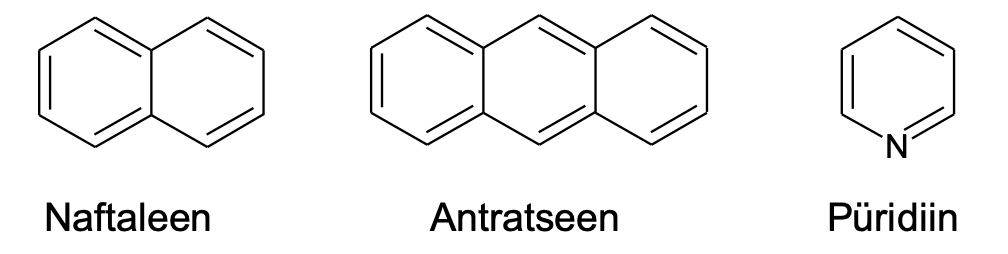
Joonis 2. Näiteid tsüklitest aromaatsetes ainetes
Aromaatsete ühendite nimetamine
Benseeni derivaatide korral võetakse tavaliselt benseen tüviühendiks ning sellega seotud rühmad nimetatakse eesliidete abil. Kui rühmi on mitu, siis üks neist märgitakse numbriga 1 ning teised nummerdatakse vastavalt oma asukohale asendi number 1 suhtes nii, et numbrid oleksid võimalikult väikesed.
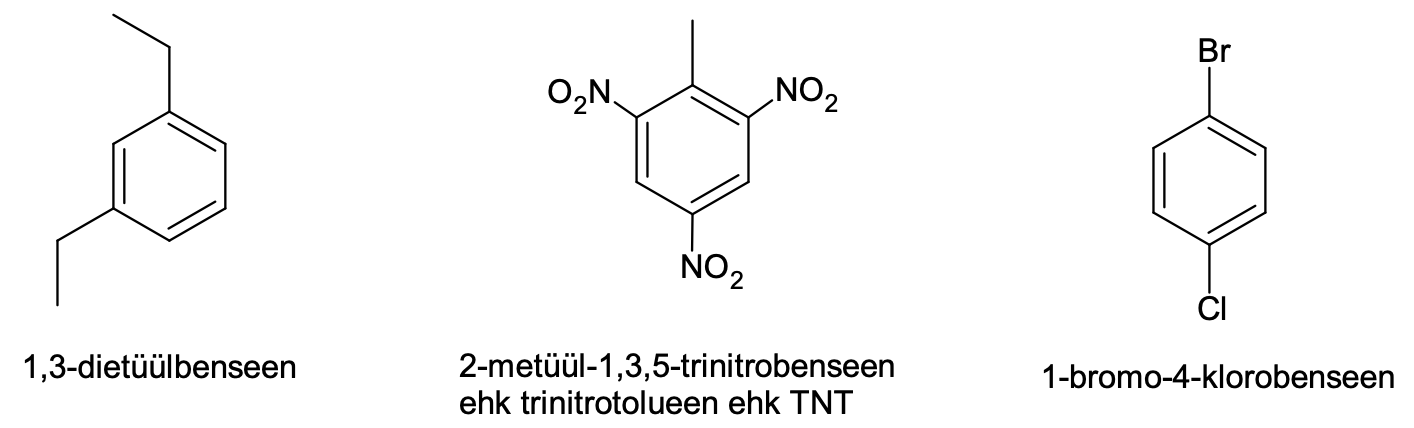
Joonis 3. Näiteid asendatud aromaatsetest ühenditest koos nende süstemaatiliste nimetustega
Aromaatsete ühendite keemilised omadused
Aromaatsetele ühenditele on iseloomulikud asendusreaktsioonid.
Erinevalt tüüpilistest küllastumata ühenditest (alkeenid ja alküünid) on aromaatsetele ühenditele iseloomulikud asendusreaktsioonid. Liitumisreaktsioone aromaatsed ühendid kergesti ei anna. Tüüpilises asendusreaktsioonis asendatakse üks aromaatse tuuma vesinikuaatom halogeeni või nitrorühmaga (-NO2). Reaktsioone nimetakse vastavalt aromaatse tuuma halogeenimiseks või nitreerimiseks. Nende reaktsioonide jaoks läheb vaja katalüsaatoreid, milleks on halogeenimisel teatud soolad (nt AlCl3, FeBr3) ja nitreerimisel kontsentreeritud väävelhape. Asendusreaktsioon võib toimuda ka mitmes etapis, nt saadakse kolme metüülbenseeni (tolueeni) vesiniku asendamisel nitrorühmaga tuntud lõhkeainet trinitrotolueeni (TNT).
C6H6 + Br2 $\xrightarrow[]{FeBr_{3}}$ C6H5Br + HBr
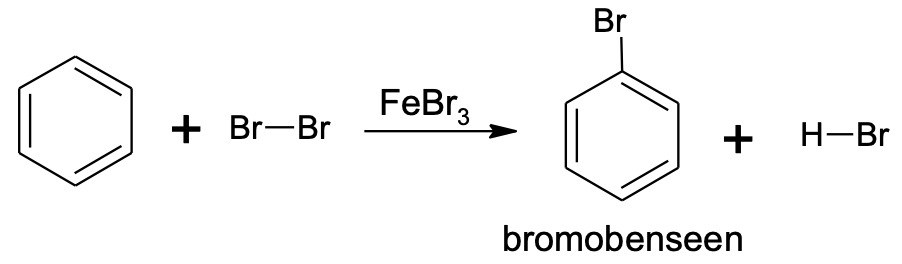
Joonis 4. Benseeni broomimine
C6H6 + HNO3 $\xrightarrow[]{FeBr_{3}}$ C6H5NO2 + H2O
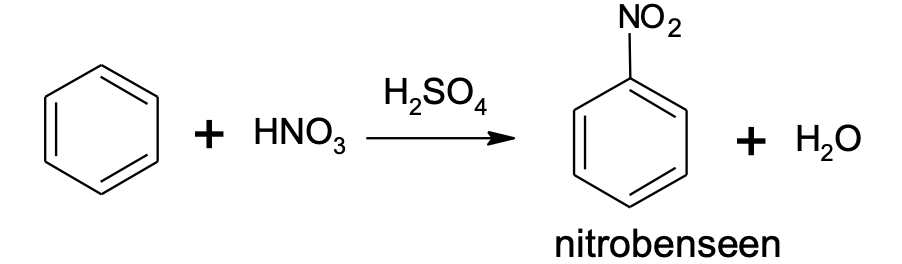
Joonis 5. Benseeni nitreerimine
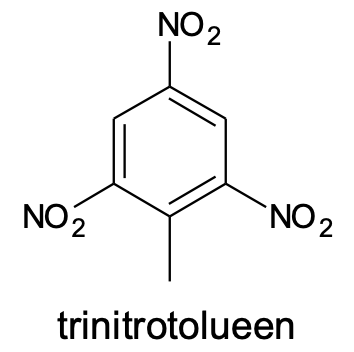
Joonis 6. Trinitrotolueen on saadud metüülbenseeni kolmeetapilisel nitreerimisel