2. Moolarvutus, lahuse kontsentratsioon
2.1. Ainehulk ja mool
Oleme harjunud kaaluma asju grammides ja kilogrammides või mõõtma pikkust meetrites ja kilomeetrites. Keemias räägitakse aga aineosakeste arvust ehk ainehulgast, mida väljendavad ka keemiliste reaktsioonide võrrandid. Mis on mool, kuidas lugeda ühendis aatomeid ning kuidas teha arvutusi ainehulga ja Avogadro arvuga, saad vaadata järgmisest videost.
Allikas: https://www.youtube.com/watch?v=U6jHEEUPsYY
Mis on ainehulk?
Ainehulk on aine kogus moolides.
$n=\frac{N}{N_{A}}$
n - ainehulk (ühik mol)
N - osakeste arv (ühik osake)
NA - Avogadro arv
(6,02 × 1023 osakest/mol)
Vaatame keemilist reaktsiooni, kus hapniku ja vesiniku ühinemisel tekib vesi:
2 H2 + O2 → 2 H2O
Reaktsioonivõrrandist järeldub, et kahe vesinikumolekuli ja ühe hapnikumolekuli omavahelisel reageerimisel tekib kaks molekuli vett. Tegelikus elus on aga väga palju rohkem aineosakesi, mis omavahel reageerivad, ning seetõttu kasutatakse ainehulga ühikuna mooli. Ainehulk on aine kogus moolides, tähis n. Ühes moolis on 6,02 ×1023 osakest. Osake võib olla nii molekul, aatom kui ka ioon.
Jäta meelde, et
1 mol = 1000 mmol
1 kmol = 1000 mol
Ainehulk on avaldatav osakeste arvu ja Avogadro arvu kaudu: $n=\frac{N}{N_{A}}$, kus n tähistab ainehulka (ühik mool, lühend mol), N osakeste arvu (ühik osakene) ning NA on Avogadro arv, mille väärtus on 6,02 $\times $ 1023 osakest/mol.
Analoogiliselt meetri, kilomeetri ja millimeetri teisendustega on võimalik ka mooli teisendada kilomooliks ja millimooliks.
Ülesanne 1
Teisenda ühikud.
Kuidas loendada aatomeid?
Kui võtame näiteks taaskord vee molekuli H2O, siis ühes molekulis vees on 2 vesinikuaatomit ja 1 hapnikuaatom. Kuna mool on hulga loendamise ühik, siis ühes moolis vees on 2 mooli vesinikuaatomeid ja 1 mool hapnikuaatomeid. Võttes 2 mooli vett, kahekordistub ka aatomite hulk. Seega kahes moolis vees on 4 mooli vesinikuaatomeid ja 2 mooli hapnikuaatomeid. Kümnes moolis vees on 20 mooli vesinikuaatomeid ja 10 mooli hapnikuaatomeid.
Ülesande 2 lahendused
2.1 Arvuta hapniku aatomite hulk moolides 2 moolis H2O-s.
Lahendus: 2 mol, sest ühes moolis vees on üks mool hapnikuaatomeid.
2.2 Arvuta hapniku aatomite hulk moolides 0.01 moolis KMnO4-s.
Lahendus: 0.04 mol, sest igas molekulis KMnO4-s on neli hapnikuaatomit.
2.3 Arvuta hapniku aatomite hulk moolides 15 moolis Ca(OH)2-s.
Lahendus: 30 mol, sest igas molekulis Ca(OH)2-s on kaks hapnikuaatomit.
2.4 Arvuta vesiniku aatomite hulk moolides järgmises gaasisegus: 1,5 mol CH4 + 6,5 mol HCl + 0,75 mol H2.
Lahendus: Kokku 14 mol vesinikuaatomeid, sest 1,5 mol CH4 sisaldab 6 mol vesinikuaatomeid, 6,5 mol HCl sisaldab 6,5 mol vesinikuaatomeid ja 0,75 mol H2 sisaldab 1,5 mol vesinikuaatomeid.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgmised sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning teosta arvutused.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Teeme koos läbi 2 näidisülesannet.
Näidisülesanne 1. Aine hulga arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 2$\times $1023 süsiniku aatomit? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 2$\times $1023 süsiniku aatomit? |
| 3. Omista arvule kindel füüsikaline suurus. | 2$\times $1023 süsiniku aatomit näitab osakeste arvu. |
| 4. Kirjuta välja andmed. Samuti on alati teada Avogadro arv. Otsitav suurus on hetkel moolide arv, järelikult n = ? |
N = 2$\times $1023 aatomit NA= 6,02$\times $1023 aatomit/mol |
| 5. Kirjuta välja valemid. Kuna antud juhul on vajalik ainehulk, siis valemist mõnda muud suurust avaldama ei pea. | $n=\frac{N}{N_{A}}$ |
|
6. Asenda arvud ja arvuta. $n=\frac{N}{N_{A}}=\frac{2\times10^{23}\,aatomit}{6.02\times10^{23}\,aatomit/mol}\approx 0.33\, mol$ |
|
Ülesanne 3
Ülesande 3 lahendused
3.1 Mitu mooli on 3,612 × 1024 ränidioksiidi molekuli?
Lahendus: 6 mol, 3,612 × 1024 näitab ränidioksiidi molekulide arvu N.
\(n = {N\over N_A}={3.612 *10^{24}aatomit \over 6.02 *10^{23}aatomit/mol } = 6 mol\)
3.2 Mitu mooli on 6,02 × 1023 ränidioksiidi molekuli?
Lahendus: 1 mol, 6,02 × 1023 näitab ränidioksiidi molekulide arvu N.
\(n = {N\over N_A}={6.02 *10^{23}aatomit \over 6.02 *10^{23}aatomit/mol } = 1 mol\)
3.3 Arvuta väävelhappe 1,204 × 1024 molekuli hulk moolides.
Lahendus: 2 mol, 1,204 × 1024 näitab väävelhappe molekulide arvu N.
\(n = {N\over N_A}={1.204 *10^{24}aatomit \over 6.02 *10^{23}aatomit/mol } = 2 mol\)
3.4 Arvuta Fe2(SO4)3 3,01 × 1024 molekuli hulk moolides.
Lahendus: 5 mol, 3,01 × 1024 näitab Fe2(SO4)3 molekulide arvu N.
\(n = {N\over N_A}={3.01 *10^{24}aatomit \over 6.02 *10^{23}aatomit/mol } = 5 mol\)
Näidisülesanne 2. Osakeste arvu arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Mitu aatomit on 6 moolis naatriumis? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu aatomit on 6 moolis naatriumis? |
| 3. Omista arvule kindel füüsikaline suurus. | 6 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. Samuti on alati teada Avogadro arv. Otsitav suurus on hetkel aatomite arv, järelikult N = ? |
n = 6 mol NA = 6,02$\times $1023 aatomit/mol |
| 5. Kirjuta välja valemid. |
Kuna antud juhul on vajalik aatomite ehk osakeste arv, siis tuleb valemist avaldada N: N = n $\times $ NA |
| 6. Asenda arvud ja arvuta. | N = n $\times $ NA = 6 mol $\times $ 6,02$\times $1023 aatomit/mol = 3,6$\times $1024 aatomit |
Ülesanne 4
Ülesande 4 lahendused
4.1 Arvuta molekulide arv 6,2 mol lämmastikoksiidis. 3,73×1024 molekuli
Lahendus: 6,2 mol näitab ainehulka n.
N=n×NA=6,2 mol×6,02×1023aatomit/mol=3,73×1024 molekuli
4.2 Arvuta molekulide arv 0,45 mol vesinikkloriidhappes. 2,71×1023 molekuli
Lahendus: 0,45 mol näitab ainehulka n.
N=n×NA=0,45 mol×6,02×1023aatomit/mol=2,71×1023 molekuli
4.3 Arvuta molekulide arv 30 mmol vees. 1,81×1022 molekuli
Lahendus: Teisendame 30 mmol moolideks. 30 mmol on 0,03 mol, see näitab ainehulka n.
N=n×NA=0,03 mol×6,02×1023aatomit/mol=1,81×1022 molekuli
4.4 Arvuta molekulide arv 15 kmol NaOH-s. 9,03×1027 molekuli
Lahendus: Teisendame 15 kmol moolideks. 15 kmol on 15000 mol, see näitab ainehulka n.
N=n×NA=15000 mol×6,02×1023aatomit/mol=9,03×1027 molekuli
2.2. Mool, mass ja molaarmass
Mool on küll keemikute seas väga laialt kasutatav ühik, aga ühtegi mõõteriista ei saa kasutada otseselt moolide mõõtmiseks. Samuti ei saa osta tavapäraselt lahtiseid komme moolides, vaid ikka grammides. Selleks, et minna ainehulgalt üle massile, kasutatakse molaarmassi. Mis on mooli ja massi seos ning kuidas leida molaarmassi ning molaarmassi kaudu aine massi, saad vaadata järgmisest videost.
Allikas: https://youtu.be/g1s_JY9rcJs
Molaarmass on ühe mooli aineosakeste mass.
Molaarmassi tähiseks on M ning keemias kõige kasutatavamaks molaarmassi ühikuks g/mol. Selleks, et leida konkreetse ühendi molaarmassi, tuleb liita aine koostises olevate elementide ümardatud aatommassid, kusjuures tuleb arvestada ka aatomite arve keemilises valemis.
Näide 1. Arvuta vee molaarmass.
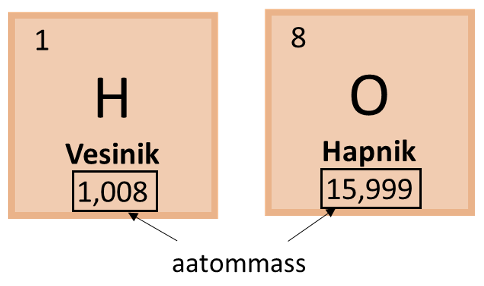 Vee keemiline valem on H2O. Molaarmassi leidmiseks kasutame perioodilisustabelis toodud aatommasse, kuid ümardame need täisarvuks. Vesiniku aatommass on 1.008 ehk ümardatuna täisarvuks 1 ning hapniku aatommass on 15.999 ehk ümardatuna täisarvuks 16. Kuna vee molekulis on 2 vesiniku aatomit, tuleb seda ka arvutuses arvestada ning vee molaarmassi leidmiseks on arvutuskäik järgmine:
Vee keemiline valem on H2O. Molaarmassi leidmiseks kasutame perioodilisustabelis toodud aatommasse, kuid ümardame need täisarvuks. Vesiniku aatommass on 1.008 ehk ümardatuna täisarvuks 1 ning hapniku aatommass on 15.999 ehk ümardatuna täisarvuks 16. Kuna vee molekulis on 2 vesiniku aatomit, tuleb seda ka arvutuses arvestada ning vee molaarmassi leidmiseks on arvutuskäik järgmine:
M(H2O) = 2 $\times $1 + 16 = 18 g/mol
Allpool on toodud mõne ühendi molaarmassid koos arvutuskäiguga. Kontrolli, kas saad samad tulemused.
M(K) = 39 g/mol
M(Al2O3) = 2 $\times $ 27 + 3 $\times $16 = 102 g/mol
M(H2SO3) = 2 $\times $ 1 + 32 + 3 $\times $ 16 = 82 g/mol
M(NaCl) = 23 + 35,5 = 58,5 g/mol
Nagu viimasest näitest selgub, on aatommasside ümardamisel erandeid. Jäta meelde, et kloori aatommassi väärtus on 35,5 ning vase oma 63,5 g/mol.
Vali õige molaarmass.Ülesanne 1
1.1 Liitiumhüdroksiid: 24 g/mol
Lahendus: M(LiOH) = 7 + 16 + 1 = 24 (g/mol)
1.2 Dilämmastikpentaoksiid: 108 g/mol
Lahendus: M(N2O5) = 2×14 + 5 × 16 = 108 (g/mol)
1.3 Naatriumsulfaat: 142 g/mol
Lahendus: M(Na2SO4) = 2×23 + 32 + 4 × 16 = 142 (g/mol)
1.4 Alumiinium(III)sulfaat: 342 g/mol
Lahendus: M[Al2(SO4)3] = 2×27 + 3(32 + 4 × 16) = 342 (g/mol)
1.5 Raud(III)karbonaat: 292 g/mol
Lahendus: M[Fe2(CO3)3] = 2×56 + 3(12 + 3 × 16) = 292 (g/mol)
Ülesande 1 lahendused
Molaarmassi seos ainehulgaga:
$n=\frac{m}{M}$
n - ainehulk (ühik mol)
m - aine mass (ühik g)
M - molaarmass (ühik g/mol)
Molaarmassi kasutades on võimalik arvutada aine hulka või massi. Ainehulk on avaldatav kui $n=\frac{m}{M}$,
kus n tähistab ainehulka (ühik mool, lühend mol), m aine massi (ühik gramm) ning M on molaarmass (ühik g/mol).
Arvutusülesannete lahendamise käiguga oled ilmselt juba tuttav, kuid kordame selle üle.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning arvuta.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Teeme koos läbi 2 ülesannet.
Näidisülesanne 1. Ainehulga arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 9,3 grammis naatriumoksiidis? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 9,3 grammis naatriumoksiidis? |
|
3. Omista arvule kindel füüsikaline suurus. |
9,3 grammi näitab aine massi. |
| 4. Kirjuta välja andmed. |
m = 9,3 g Samuti on hetkel teada, et aineks on naatriumoksiid, mille valem on Na2O. Igale ainele, mille valemit sa tead, saab leida molaarmassi. M(Na2O) = 2 $\times $ 23 + 16 = 62 g/mol Otsitav suurus on hetkel moolide arv, järelikult n = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{m}{M}$ Kuna antud juhul on vajalik ainehulk, siis valemist mõnda teist suurust avaldama ei pea. |
| 6. Asenda arvud ja arvuta. | $n=\frac{m}{M}=\frac{9,3\ g}{62\ g/mol}=0,15\ mol$ |
Ülesanne 2
Arvuta ainehulk.
Ülesande 2 lahendused
2.1 Mitu mooli on 3,12 grammi alumiiniumhüdroksiidi? 0,04 mol
Lahendus: 3,12 grammi näitab alumiiniumhüdroksiidi massi m. Alumiiniumhüdroksiidi valem on Al(OH)3, leiame sellele molaarmassi.
M[Al(OH)3] = 27 + 3(16 + 1) = 78 g/mol
Otsitav suurus on moolide arv n.
\(x = {m \over M} = {3.12g\over78 g/mol} = 0.04mol\)
2.2. Mitu mooli on 0,5 kg vääveltrioksiidi? 6,25 mol
Lahendus: 0,5 kg näitab vääveltrioksiidi massi m. Teisendame selle grammideks.
0,5 kg = 500 g
Vääveltrioksiidi valem on SO3, leiame sellele molaarmassi.
M(SO3) = 32 + 3 × 16 = 80 g/mol
Otsitav suurus on moolide arv n.
\(x = {m \over M} = {500g\over80 g/mol} = 6.25mol\)
2.3. Mitu mooli on 800 grammi raud(III)hüdroksiidi? 7,48 mol
Lahendus: 800 g näitab raud(III)hüdroksiidi massi m.
Raud(III)hüdroksiidi valem on Fe(OH)3, leiame sellele molaarmassi.
M[Fe(OH)3] = 56 + 3(16 + 1) = 107 g/mol
Otsitav suurus on moolide arv n.
\(x = {m \over M} = {800g\over 107 g/mol} = 7.48mol\)
2.4. Mitu mooli on 450 g vett? 25 mol
Lahendus: 450 g näitab vee massi m.
Vee molekulvalem on H2O, leiame sellele molaarmassi.
M(H2O) = 2×1 + 16 = 18 g/mol
Otsitav suurus on moolide arv n.
\(x = {m \over M} = {450g\over18 g/mol} = 25mol\)
Näidisülesanne 2. Aine massi arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Arvuta 3 mol kaaliumnitraadi mass. |
| 2. Jooni alla kõik arvud, mis on tekstis. | Arvuta 3 mol kaaliumnitraadi mass. |
| 3. Omista arvule kindel füüsikaline suurus. | 3 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. |
n = 3 mol Samuti on hetkel teada, et aineks on kaaliumnitraat, mille valem on KNO3, mille molaarmass on: M(KNO3) = 39 + 14 + 3 $\times $ 16 = 101 g/mol Otsitav suurus on hetkel mass, järelikult m = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{m}{M}$ Kuna antud juhul on vajalik mass, siis mass avaldub: m = n $\times $ M |
| 6. Asenda arvud ja arvuta. |
m = 3 mol $\times $ 101 g/mol = 303 g Ka ühikutega saad sama tehte teha: mol × g/mol, milles moolid taanduvad maha ning alles jääb massi ühik g. |
Ülesanne 3
Ülesande 3 lahendused
3.1. Kui suur mass on 0,15 mol naatriumhüdroksiidil? 6 g
Lahendus: 0,15 mol näitab ainehulka (moolide arvu) n. Naatriumhüdroksiidi valem on NaOH, sellele saame arvutada molaarmassi.
M(NaOH) = 22 + 16 + 1 = 40 g/mol
Otsitav suurus on mass m.
m = n × M = 0,15 mol × 40 g/mol = 6 g
3.2. Kui suur mass on 31 mmol lämmastikhappel? 1,95 g
Lahendus: 31 mmol näitab ainehulka (moolide arvu) n. Teisendame selle moolideks.
31 mmol = 0,031 mol
Lämmastikhappe valem on HNO3, sellele saame arvutada molaarmassi.
M(HNO3) = 1 + 14 + 3×16 = 63 g/mol
Otsitav suurus on mass m.
m = n × M = 0,031 mol × 63 g/mol = 1,95 g
3.3. Kui suur mass on 6,02×1023 vee molekulil? 18 g
Lahendus: 6,02×1023 näitab vee molekulide arvu N. Kuna alati on teada Avogadro arv NA = 6,02×1023 aatomit/mol, saame leida vee moolide arvu.
\(n={N \over N_A} = {{6.02 * 10^{23} aatomit} \over 6.02 * 10^{23}aatomit/mol} = 1mol\)
Aine massi leidmiseks peame arvutama selle molaarmassi. Vee molekulvalem on H2O, leiame sellele molaarmassi.
M(H2O) = 2×1 + 16 = 18 g/mol
Leiame nüüd otsitava suuruse, massi m:
m = n × M=1 mol × 18 g/mol = 18 g
3.4. Vasta küsimustele.
Lahendus: Arvuta aine molaarmass, kui on teada, et 270 grammis aines oli aine hulk 15 mol. Vastus: 18 g/mol
Teada on aine mass m = 270 g ja aine hulk n = 15 mol. Nende andmetega saame leida otsitava suuruse, molaarmassi M.
\(M ={m \over n}= {270g \over 15 mol} = 18 g/mol\)
2.3. Ruumala seos mooliga
Vedelike või tahkete ainete massi on mugav mõõta kaalumise teel. Gaasiliste ainete massi leidmine on aga küllaltki keeruline protseduur. Palju lihtsam on mõõta gaasiliste ainete ruumala ehk mahtu. Gaasilise aine hulga ja ruumala seob omavahel molaarruumala.
Molaarruumala on ühe mooli aineosakeste ruumala. Molaarruumala tähis on Vm ja ühik dm3/mol.
Erinevad gaasid sisaldavad ühesugustel tingimustel võrdse ruumala korral võrdse arvu molekule. Sellest tulenevalt on erinevate gaaside molaarruumalad ühesugustel tingimustel võrdsed. Normaaltingimustel on kõikide gaaside molaarruumala 22,4 dm3/mol.
Normaaltingimustel on temperatuur 0ºC ja rõhk 1 atm.
Gaaside ruumala arvutamise korral tuleb alati arvestada temperatuuri ja rõhku. Seetõttu kasutatakse keemias tihti väljendit normaaltingimused (lühendina nt).
Kuidas molaarruumala leida ning seda erinevates arvutustes kasutada, saad vaadata videost.
Allikas: https://youtu.be/taWb_GV6NXM
Ainehulk on avaldatav ruumalade kaudu: $n=\frac{V}{V_{m}}$
Molaarruumala kasutades on võimalik arvutada gaasilise aine hulka või ruumala. Ainehulk on avaldatav ruumalade kaudu:
$n=\frac{V}{V_{m}}$,
kus n on ainehulga tähis (ühik mool, lühend mol), V on aine ruumala (ühik dm3) ning Vm on molaarruumala (väärtus 22,4 dm3/mol, nt.).
Ülesanne 1
Arvutusülesannete lahendamise käiguga oled juba tuttav, kuid kordame selle üle.
Arvutusülesannete lihtsamaks lahendamiseks võid eeskujuks võtta järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning arvuta.
Ole valmis, et mõnikord tuleb ühikuid teisendada!
Teeme koos läbi 3 ülesannet.
Näidisülesanne 1. Ainehulga arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli on 60 dm3 hapnikku (nt.)? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Mitu mooli on 60 dm3 hapnikku (nt.)? |
| 3. Omista arvule kindel füüsikaline suurus. | 60 dm3 näitab aine ruumala. |
| 4. Kirjuta välja andmed. |
V = 60 dm3 Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on moolide arv, järelikult n = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna antud juhul tuleb leida ainehulk, siis valemist mõnda teist suurust avaldama ei pea. |
| 6. Asenda arvud ja arvuta. | $n=\frac{V}{V_{m}}=\frac{60\ dm^{3}}{22,4\ dm^{3}/mol}\approx 2,7\ mol$ |
Ülesanne 2
Arvuta ainehulk.
Ülesande 2 lahendused
2.1. Mitu mooli on 2,8 dm3 lämmastikku (nt.)? 0.125 mol
Lahendus: 2,8 dm3 näitab aine ruumala V.
Samuti on teada gaasi molaarruumala Vm = 22,4 dm3/mol.
Otsitav suurus on moolide arv n = ?
\(n = {V\over V_M}={2.8dm^3 \over 22.4 dm^3/mol}=0.125 mol\)
2.2. Mitu millimooli on 7 l süsinikoksiidi (nt.)? 312.5 mmol
Lahendus: 7 l näitab aine ruumala V. Selle saab teisendada kuupdetsimeetriteks.
V = 7 l = 7 dm3
Samuti on teada gaasi molaarruumala Vm = 22,4 dm3/mol.
Otsitav suurus on moolide arv n, kusjuures vastus tuleb teisendada millimoolideks.
\(n = {V\over V_M}={7dm^3 \over 22.4 dm^3/mol}=0.3125 mol=312.5mmol\)
2.3. Mitu kilomooli on 336 dm3 süsinikdioksiidi (nt.)? 0.015 kmol
Lahendus: 336 dm3 näitab aine ruumala V.
Samuti on teada gaasi molaarruumala Vm = 22,4 dm3/mol.
Otsitav suurus on moolide arv n, kusjuures vastus tuleb teisendada kilomoolideks.
\(n = {V\over V_M}={336dm^3 \over 22.4 dm^3/mol}=15 mol=0.015kmol\)
Näidisülesanne 2. Aine ruumala arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Arvuta 8 mol süsihappegaasi ruumala (nt). |
| 2. Jooni alla kõik arvud, mis on tekstis. | Arvuta 8 mol süsihappegaasi ruumala (nt). |
| 3. Omista arvule kindel füüsikaline suurus. |
8 mol näitab ainehulka. |
| 4. Kirjuta välja andmed. |
n = 8 mol Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on ruumala: V = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna vaja on ruumala, siis see avaldub: V = n $\times $ Vm |
| 6. Asenda arvud ja arvuta. | V = 8 mol $\times $ 22,4 dm3/mol = 179,2 dm3 |
Ülesanne 3
Ülesande 3 lahendused
3.1. Kui suur ruumala (dm3-tes) on 3,4 mol vesinikul (nt.)? 76,16 dm3
Lahendus: 3,4 mol näitab ainehulka n. Samuti on teada gaasi molaarruumala Vm = 22,4 dm3/mol.
Otsitav suurus on ruumala V.
V = n × Vm = 3,4 mol × 22,4 dm3/mol = 76,16 dm3
3.2. Mitu kuupmeetrit on 350 mol hapniku ruumala (nt.)? 7,84 m3
Lahendus: 350 mol näitab ainehulka n. Samuti on teada gaasi molaarruumala Vm = 22,4 dm3/mol.
Otsitav suurus on ruumala V, kusjuures vastus tuleb teisendada kuupmeetritesse.
V = n × Vm = 350 mol × 22,4 dm3/ mol = 7840 dm3 = 7,84 m3
3.3. Kui suur ruumala cm3-tes on 15 mmol lämmastikul (nt.)? 336 cm3
Lahendus: 15 mmol näitab ainehulka n. Samuti on teada gaasi molaarruumala Vm = 22,4 dm3/mol. Kuna 1 dm3 on 1000 cm3 ja 1 mol on 1000 mmol, saame seda esitada ka kujul 22,4 cm3/mmol.
Otsitav suurus on ruumala V, kusjuures vastus tuleb teisendada kuupsentimeetritesse.
V = n × Vm =15 mmol × 22,4 cm3/ mmol = 336 cm3
Näidisülesanne 3. Aine ruumala arvutamine aine massi kaudu
| 1. Loe ülesande tekst mõttega läbi. | Kui suur on 23 grammi vesiniku ruumala (nt)? |
| 2. Jooni alla kõik arvud, mis on tekstis. | Kui suur on 23 grammi vesiniku ruumala (nt)? |
| 3. Omista arvule kindel füüsikaline suurus. | 23 g on aine mass. |
| 4. Kirjuta välja andmed. |
m = 23g Samuti on teada gaasi molaarruumala. Vm = 22,4 dm3/mol Otsitav suurus on ruumala, järelikult V = ? |
| 5. Kirjuta välja valemid. |
$n=\frac{V}{V_{m}}$ Kuna otsitav suurus on ruumala, siis see avaldub: V = n $\times $ Vm Ruumala arvutamise valemis on ainehulk, mille saad omakorda arvutada valemist: $n=\frac{m}{M}$ Aine molaarmassi saad arvutada aatommasside kaudu, võttes appi perioodilisuse tabeli. |
| 6. Asenda arvud ja arvuta. |
M(H2)=2 g/mol $n=\frac{m}{M} = \frac{23\ g}{2\ \frac{g}{mol}}=11,5\ mol$ V = n $\times $ Vm= 11,5 mol $\times $ 22,4 dm3/mol=257,6 dm3 Kontrolliks võid ülesande läbi teha ka ühikutega. Ainehulga pead saama moolides:
Ruumala pead saama ruumalaühikutes (cm3, dm3, m3):
|
Ülesanne 4
Ülesande 4 lahendused
4.1 Kumma gaasi ruumala on (nt.) suurem, kas 44 g süsinikdioksiidi või 35 g süsinikoksiidi? Süsinikoksiid
Lahendus: Leiame kummagi gaasi ainehulgad n. Selleks tuleb esmalt arvutada nende molaarmassid.
M(CO2) = 12 + 2×16 = 44 g/mol
M(CO) = 12 + 16 = 28 g/mol
\(n(CO_2) ={m\over M}= {44g \over 44 g/mol}=1mol\)
\(n(CO) ={m\over M}= {35g \over 28 g/mol}=1.25mol\)
Ainehulkade kaudu saame leida ruumalad, sest teada on Vm = 22,4 dm3/mol.
V(CO2) = n × Vm = 1 mol × 22,4 dm3/mol = 22,4 dm3
V(CO) = n × Vm = 1,25 mol × 22,4 dm3/mol = 28 dm3
4.2. Kui suur mass on 5,6 dm3 vääveldioksiidil (nt.)? 16 g
Lahendus: Leiame ainehulga n.
\(n ={V\over V_M}= {5.6dm^3 \over 22.4 dm^3/mol}=0.25mol\)
Leiame vääveldioksiidi molaarmassi:
M(SO2) = 32 + 2×16 = 64 g/mol
Sellest saab arvutada vääveldioksiidi massi.
m = n × M = 0,25 mol × 64 g/mol = 16 g
4.3. Mitu kilogrammi on 84 m3 süsinikdioksiidi mass (nt.)? 165 kg
84 m3 näitab aine massi m. Samuti on teada gaasi molaarruumala Vm = 22,4 dm3/mol. Kuna 1 dm3 on 0,001 m3 ja 1 mol on 0,001 kmol, saame seda esitada ka kujul 22,4 m3/kmol. Leiame ainehulga n.
\(n ={V\over V_M}= {85m^3 \over 22.4 m^3/kmol}=3.75kmol\)
Leiame süsinikdioksiidi molaarmassi:
M(CO2) = 12 + 2×16 = 44 g/mol = 44 kg/kmol
Sellest saab arvutada süsinikdioksiidi massi.
m = n × M = 3,75 kmol × 44 kg/kmol = 165 kg
PS: Ülesande arvutused võib teha ka nii, et arvutused teed ühikutega dm3, mol ja dm3/mol ning teisendad alles viimases arvutuses massi kg-ks. Lõppvastus peab tulema sama olenemata sellest, mis ühikutes arvutad.
4.4. Balloonis on normaaltingimustel 200 liitrit hapnikku. Leia balloonis oleva hapniku mass. 286 g
Lahendus: Teada on hapniku ruumala V.
V = 200 l = 200 dm3
Leiame ainehulga n.
\(n ={V\over V_M}= {200dm^3 \over 22.4dm^3/mol}=8.93mol\)
Leiame hapniku molaarmassi:
M(O2) = 2×16 = 32 g/mol
Ja arvutame hapniku massi:
m = n × M = 8,93 mol × 32 g/mol ≈ 286 g
2.4. Arvutusülesanded reaktsioonivõrrandi põhjal
Keemias tuleb sageli teha arvutusi reaktsioonivõrrandite põhjal. Selleks tuleb kõigepealt kirjutada reaktsioonivõrrand ja see ka tasakaalustada. Reaktsioonivõrrandis olevad kordajad näitavad reageerivate ja tekkivate ainete hulka moolides. Kuidas reaktsioonivõrrandi kordajaid arvutustes kasutada ning milliseid arvutusi reaktsioonivõrrandi alusel võib teha, saad vaadata järgmisest videost.
Allikas: https://youtu.be/m-orM45x_iw
Reaktsioonivõrrandi kordajad väljendavad reageerivate ainete hulkade suhet moolides.
Selleks, et teha arvutusi reaktsioonivõrrandite põhjal, tuleb kõigepealt aru saada, et reaktsioonivõrrandi kordajad väljendavad reageerivate ainete hulkade suhet moolides.
Võttes aluseks lihtsa keemilise reaktsiooni, kus hapniku ja vesiniku ühinemisel tekib vesi, saame kirja panna järgneva reaktsioonivõrrandi:
2 H2 + O2 → 2 H2O
Reaktsioonivõrrand näitab, et kaks mooli vesinikku reageerib ühe mooli hapnikuga ning tekib kaks mooli vett. Oletame, et meil on vaja saada aga 10 mooli vett. Tasakaalus reaktsioonivõrrandi kohaselt on meil aga kaks mooli vett. Selleks, et saada 10 mooli vett, tuleb võtta viiekordne kogus aineid. Seega saame öelda, et 10 mooli vee saamiseks on vaja:
vesinikku 5 $\times $ 2 mol = 10 mol
hapnikku 5 $\times $ 1 mol = 5 mol
Arvutusülesannete lahendamisel võid juhinduda järgnevatest sammudest:
- Loe ülesande tekst mõttega läbi ning pane paika lähteained ja saadused.
- Kirjuta tekstile vastav reaktsioonivõrrand ning tasakaalusta see.
- Kirjuta välja andmed ja otsitav suurus.
- Lähteainete massid või ruumalad tuleb ümber arvutada moolideks.
- Kasutades moolsuhet (reaktsioonivõrrandi kordajaid) leia otsitava aine hulk moolides.
- Vajadusel arvuta otsitava aine moolid ümber massiks või ruumalaks.
Tuleta varasemast meelde ka järgmised valemid, mida võib arvutustes vaja minna. Ainehulga arvutamine:
$n=\frac{m}{M}$
n - ainehulk (ühik mool, lühend mol)
m - aine massi (ühik gramm)
M - molaarmass (ühik g/mol)
$n=\frac{N}{N_{A}}$
N - osakeste arv (ühik osakene)
NA - Avogadro arv, mille väärtus on 6,02 ×1023 osakest/mol
$n=\frac{V}{V_{m}}$
V - aine ruumala (ühik dm3)
Vm - molaarruumala (väärtus 22,4 dm3/mol normaaltingimustel)
Näidisülesanne 1. Moolilt moolile üleminek
| 1. Loeme teksti läbi ning paneme kirja lähteained, milleks on vesinik ja hapnik. | Mitu mooli hapnikku kulub reageerimiseks 12 mol vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2 H2 + O2 → 2H2O |
| 3. Kirjutame välja andmed ja otsitava. |
n(H2) = 12 mol n(O2) = ? |
| 4. Vaja on leida ühe aine moolid teise aine moolide järgi. Seega ei pea üle minema ei massile ega ruumalale, vaid lihtsalt arvestama moolsuhet. |
Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja O2 moolsuhe on 2:1. Kirjutame välja järgneva seose: 2 – 1 12 mol – x mol |
| 5. Avaldame hapniku moolide arvu. |
$n(O_{2})=\frac{12\ mol\times 1}{2}= 6\ mol$ Kui sa ei soovi seost välja kirjutada, võid ka mõelda, et hapnikku peab olema 2 korda vähem kui vesinikku ning sellest tulenevalt saad arvutada n(O2) = 12 mol / 2 = 6 mol |
Ülesande 1 lahendused
1.1. Mitu mooli hapnikku kulub reageerimiseks 12 mooli kaaliumiga?
Vastus: 3 mol
Lahendus. Esmalt kirjutame välja reaktsioonivõrrandi kaaliumi ja hapniku vahel.
4K + O2 → 2K2O
Meil on teada kaaliumi moolide arv (12 mol), otsime hapniku moolide arvu.
n(K) = 12 mol
n(O2) = ?
Tasakaalustatud reaktsioonivõrrandist on näha, et K ja O2 moolsuhe on 4:1. Järelikult peab O2 moolide arv olema 4 korda väiksem ehk 12/4 = 3 mol.
Alternatiivse lahendusena kirjutame välja järgneva seose:
4 – 1 = 12 mol – x mol (x on hapniku moolide arv)
Siit saame avaldada hapniku moolide arvu: \(n(O_2)= {12mol*1 \over 4}=3mol\)
1.2. Etanool, mille summaarne valem on C2H6O, põleb hapniku juuresolekul andes vee ja süsihappegaasi. Mitu mooli etanooli põles, kui reaktsiooni käigus eraldus 2,5 mooli süsihappegaasi?
Vastus: 1,25 mol
Lahendus: Kirjutame välja etanooli hapniku juuresolekul põlemise võrrandi:
C2H6O + 3O2 → 2CO2 + 3H2O
Siit näeme, et ühe mooli etanooli põlemisel tekib kaks mooli süsihappegaasi, suhe on 1:2. Reaktsiooni käigus tekkis 2,5 mooli süsihappegaasi, seega etanooli oli kaks korda vähem ehk 1,25 mooli.
1.3. Naatriumhüdroksiidi ja vesinikkloriidhappe vahelist reaktsiooni nimetatakse ka neutralisatsioonireaktsiooniks. Mitu mooli naatriumhüdroksiidi peab reageerima 73 grammi vesinikkloriidhappega selle mõju neutraliseerimiseks?
Vastus: 2 mol
Lahendus: Kirjutame välja naatriumhüdroksiidi ja vesinikkloriidhappe vahelise neutralisatsioonireaktsiooni:
NaOH + HCl → NaCl + H2O
On teada HCl mass (m = 73 grammi), mille põhjal saame leida HCl moolide arvu n.
\(n={m \over M} = {73g \over 36,5 g/mol} = 2mol\)
Reaktsioonivõrrandist näeme, et naatriumhüdroksiidi ja vesinikkloriidhappe moolsuhe on 1:1. Järelikult on naatriumhüdroksiidi tarvis samuti 2 mooli.
1.4. Rakuhingamise saab summaarselt kokku võtta järgmise reaktsiooniga:
C6H12O6 + 6O2 → 6CO2 + 6H2O
Mitu mooli hapnikku kulub 15 mooli glükoosi lagundamiseks?
Vastus: 90 mol
Lahendus: Reaktsioonivõrrandist näeme, et glükoosi ja hapniku moolsuhe on 1:6. Seega kulub glükoosi lagundamisel hapnikku kuus korda rohkem kui glükoosi ehk 15 × 6 = 90 mol.
Näidisülesanne 2. Moolilt massile üleminek
| 1. Loeme teksti läbi ning paneme kirja, et nii vesinik kui ka hapnik on lähteained ning tekib vesi. | Mitu grammi vett tekib, kui hapnik reageerib 2 mol vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2 H2 + O2 → 2 H2O |
| 3. Kirjutame välja andmed ja otsitava. |
n(H2) = 2 mol m(H2O) = ? |
| 4. Vaja on leida ühe aine mass teise aine moolide arvu järgi. Järelikult tuleb kõigepealt leida vee moolide arv, arvestades moolsuhet. | Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja H2O moolsuhe on 2:2 ehk moolide arvud on võrdsed. Sellest saame järeldada, et ka n(H2O) = 2 mol. |
|
5. Ülesandes küsitakse aga vee massi. |
Moolid ja massid sidus järgnev valem: $n=\frac{m}{M}$ |
| 6. Avaldame valemist massi: | m = n $\times $ M |
| 7. Arvutame H2O molaarmassi: | M(H2O) = 2 $\times $ 1 + 16 = 18 g/mol |
| 8. Arvutame H2O massi: | m = n $\times $ M = 2 mol $\times $ 18 g/mol = 36 g |
Ülesande 2 lahendused
2.1 Magneesiumi ja vesinikkloriidhappe vahelisel reaktsioonil eraldub vesinikku. Mitu mooli vesinikku eraldub reaktsioonil 3,6 grammi magneesiumiga?
Vastus: 0,15 mol
Lahendus: Kirjutame välja magneesiumi ja vesinikkloriidhappe vahelise reaktsiooni:
Mg + 2HCl → MgCl2 + H2
On teada magneesiumi mass m(Mg) = 3,6 grammi, vaja on leida vesiniku moolide arv n(H2). Reaktsioonivõrrandist näeme, et ühe mooli magneesiumi reageerimisel tekib üks mool vesinikku ehk moolsuhe on 1:1. Järgmise sammuna leiame magneesiumi moolide arvu:
\(n= {m\over M} = {3.6g \over 24g/mol}=0.15mol\)
Kuna moolsuhe on 1:1, tekib vesinikku samuti 0,15 mol.
2.2 Naatriumhüdroksiidi ja vesinikkloriidhappe vahelist reaktsiooni nimetatakse ka neutralisatsioonireaktsiooniks. Mitu grammi naatriumhüdroksiidi peab reageerima 73 grammi vesinikkloriidhappega selle mõju neutraliseerimiseks?
Vastus: 80 g
Lahendus: Kirjutame välja naatriumhüdroksiidi ja vesinikkloriidhappe vahelise neutralisatsioonireaktsiooni:
NaOH + HCl → NaCl + H2O
On teada HCl mass (m = 73 grammi), mille põhjal saame leida HCl moolide arvu n.
\(n= {m\over M} = {73g \over 36,5g/mol}=2mol\)
Reaktsioonivõrrandist näeme, et naatriumhüdroksiidi ja vesinikkloriidhappe moolsuhe on 1:1. Järelikult on naatriumhüdroksiidi tarvis samuti 2 mooli. Leiame selle ainehulga massi:
m = n × M = 2 mol × 40 g/mol = 80 g
2.3 Mitu mooli väävelhapet kulub reageerimiseks 35 grammi liitiumiga?
Vastus: 2,5 mol
Lahendus: kirjutame välja reaktsioonivõrrandi: 2Li + H2SO4 → Li2SO4 + H2
Näeme, et liitiumi ja väävelhappe moolsuhe on reageerimisel 2:1. Meil on teada liitiumi mass (m = 35 g), sellest leiame liitiumi moolide arvu:
\(n= {m\over M} = {35g \over 7g/mol}=5mol\)
Moolsuhte 2:1 järgi leiame, et väävelhapet kulub kaks korda vähem kui liitiumit, seega 5/2 = 2,5 mooli.
2.4 Rakuhingamise saab summaarselt kokku võtta järgmise reaktsiooniga:
C6H12O6 + 6O2 → 6CO2 + 6H2O
Mitu grammi hapnikku kulub 15 mooli glükoosi lagundamiseks?
Vastus: 2880 g
Lahendus: Reaktsioonivõrrandist näeme, et glükoosi ja hapniku moolsuhe on 1:6. Seega kulub glükoosi lagundamisel hapnikku kuus korda rohkem kui glükoosi ehk 15×6 = 90 mol. Leiame selle ainehulga massi:
m = n × M = 90 mol × 32 g/mol = 2880 g
Näidisülesanne 3. Moolilt ruumalale üleminek
| 1. Loeme teksti läbi ning paneme kirja lähteained vesiniku ja hapniku. |
Mitu kuupdetsimeetrit hapnikku reageerib 3 mol vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2 H2 + O2 → 2 H2O |
|
3. Kirjutame välja andmed ja otsitava. |
n(H2) = 3 mol V(O2) = ? |
| 4. Vaja on leida ühe aine ruumala teise aine moolide järgi. Seega tuleb kõigepealt leida hapniku moolid, arvestades moolsuhet. | Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja O2 moolsuhe on 2:1 ehk hapnikku on 2 korda vähem. Sellest saame järeldada, et n(O2) = 3 mol / 2 = 1,5 mol. |
| 5. Ülesandes küsitakse aga hapniku ruumala. |
Moolid ja ruumala sidus järgnev valem: |
| 6. Avaldame valemist ruumala: | V = n $\times $ Vm |
| 7. Arvutame hapniku ruumala: | V = n $\times $ Vm = 1,5 mol $\times $ 22,4 dm3/mol = 33,6 dm3 |
Ülesande 3 lahendused
3.1 Magneesiumi ja vesinikkloriidhappe vahelisel reaktsioonil eraldub vesinikku. Mitu kuupdetsimeetrit vesinikku (nt.) eraldub reaktsioonil 3,6 grammi magneesiumiga?
Vastus: 3,36 dm3
Lahendus: Kirjutame välja magneesiumi ja vesinikkloriidhappe vahelise reaktsiooni:
Mg + 2HCl → MgCl2 + H2
On teada magneesiumi mass m(Mg) = 3,6 grammi, vaja on leida vesiniku ruumala V(H2). Reaktsioonivõrrandist näeme, et ühe mooli magneesiumi reageerimisel tekib üks mool vesinikku ehk moolsuhe on 1:1. Järgmise sammuna leiame magneesiumi moolide arvu:
\(n= {m\over M} = {3,6g \over 24g/mol}=0,15mol\)
Kuna moolsuhe on 1:1, tekib vesinikku samuti 0,15 mol. Leiame molaarruumala abil selle ainehulga ruumala:
V = n × Vm= 0,15 mol ×22,4 dm3/mol = 3,36 dm3
3.2 Mitu kuupdetsimeetrit vesinikku (nt.) tekib väävelhappe reageerimisel 35 grammi liitiumiga?
Vastus: 56 dm3
Lahendus: Kirjutame välja reaktsioonivõrrandi: 2Li + H2SO4 → Li2SO4 + H2
Näeme, et liitiumi ja tekkiva vesiniku moolsuhe on 2:1. Meil on teada liitiumi mass (m = 35 g), sellest leiame liitiumi moolide arvu:
\(n= {m\over M} = {35g \over 7g/mol}=5mol\)
Moolsuhte 2:1 järgi leiame, et vesinikku tekib moolides kaks korda vähem kui on reageerivat liitiumi, seega 5/2 = 2,5 mooli. Leiame molaarruumala abil selle ainehulga ruumala:
V = n × Vm = 2,5 mol ×22,4 dm3/mol = 56 dm3
3.3 Mitu kuupdetsimeetrit hapnikku kulub reageerimiseks 6,8 dm3 vesinikuga (nt.)?
Vastus: 3,4 dm3
Lahendus: kirjutame välja reaktsioonivõrrandi: 2H2 + O2 → 2H2O
Näeme, et vesiniku ja hapniku moolsuhe on 2:1. Leiame vesiniku ruumala kaudu vesiniku moolide arvu:
\(n= {V\over V_m} = {6,8dm^3 \over 22,4dm^3/mol}=0.3mol\)
Hapnikku kulub moolides kaks korda vähem kui vesinikku, seega 0,3/2 = 0,15 mooli. Sellest saame leida hapniku ruumala:
V = n × Vm= 0,15 mol × 22,4 dm3/mol = 3,4 dm3
Alternatiivse lahendusena saab moolsuhte abil otse vesiniku ruumala teades hapniku ruumala leida, sest aine moolide arv n ja ruumala V on omavahel seoses konstandi, molaarruumala Vm kaudu. Seega, kuna vesiniku ruumala V on 6,8 dm3 ja moolsuhe hapnikuga on 2:1, kulub hapnikku kaks korda vähem ehk 6,8/2 = 3,4 dm3.
3.4 Rakuhingamise saab summaarselt kokku võtta järgmise reaktsiooniga:
C6H12O6 + 6O2→ 6CO2 + 6H2O
Mitu liitrit hapnikku (nt.) kulub 0,5 mooli glükoosi lagundamiseks?
Vastus: 67,2 liitrit
Lahendus: Reaktsioonivõrrandist näeme, et glükoosi ja hapniku moolsuhe on 1:6. Seega kulub glükoosi lagundamisel hapnikku kuus korda rohkem kui glükoosi ehk 0,5×6 = 3 mol. Leiame selle hapniku ainehulga ruumala:
V = n × Vm= 3 mol ×22,4 dm3/mol = 67,2 dm3=67,2 l
Näidisülesanne 4. Massilt ruumalale üleminek
| 1. Loeme teksti läbi ning paneme kirja lähteained vesiniku ja hapniku. | Mitu kuupdetsimeetrit hapnikku reageerib 6 grammi vesinikuga? |
| 2. Kirjutame ja tasakaalustame tekstile vastava reaktsioonivõrrandi. | 2 H2 + O2 → 2 H2O |
| 3. Kirjutame välja andmed ja otsitava. |
m(H2) = 6 g V(O2) = ? |
| 4. Pea meeles, et moolide hulk seob reaktsioonivõrrandis kahte ainet omavahel. |
Seega tuleb kõigepealt leida moolide arv ainele, mille kohta algandmetes on infot. Kuna vesiniku mass on antud, saab leida vesiniku moolide arvu, kasutades valemit: $n=\frac{m}{M}$ M(H2) = 2 $\times $ 1 = 2 g/mol $n(H_{2})=\frac{6\ g}{2\ g/mol}= 3\ mol$ |
| 5. Kui teame vesiniku moolide arvu, saame leida ka hapniku moolide arvu. |
Tasakaalustatud reaktsioonivõrrandist on näha, et H2 ja O2 moolsuhe on 2:1 ehk hapnikku on 2 korda vähem. Sellest saame järeldada, et n(O2) = 3 mol / 2 = 1,5 mol. |
| 6. Ülesandes küsiti aga hapniku ruumala. | Moolid ja ruumala sidus järgnev valem: $n=\frac{V}{V_{m}}$ |
| 7. Avaldame valemist ruumala. | V = n $\times $ Vm |
| 8.Arvutame hapniku ruumala. | V = n $\times $ Vm = 1,5 mol $\times $ 22,4 dm3/mol = 33,6 dm3 |
Ülesande 4 lahendused
4.1 Mitu grammi vett tekib 2,8 dm3 hapniku (nt.) reageerimisel vesinikuga?
Vastus: 4,5 grammi
Lahendus: kirjutame välja reaktsioonivõrrandi: 2H2 + O2 → 2H2O
Antud on hapniku ruumala V(O2), tarvis on leida vee mass m(H2O). Ruumalalt massile üleminekuks tuleb leida ainehulgad moolides. Hapniku ruumala teades saame leida hapniku moolide arvu:
\(n= {V\over V_m} = {2.8dm^3 \over 22,4dm^3/mol}=0.125mol\)
Reaktsioonivõrrandist selgub, et hapniku ja tekkiva vee moolsuhe on 1:2. Kuna hapnikku on 0,125 mol, tekib vett 0,125×2 = 0,25 mol. Siit saame juba leida vee massi:
m = n × M = 0,25 mol × 18g/mol = 4,5 g
4.2 Inimene hingab ööpäevas välja umbes 470 dm3 süsinikdioksiidi. Mitu grammi glükoosi (C6H12O6) tekib sellise koguse süsinikdioksiidi täielikul sidumisel taimede poolt fotosünteesi käigus? (Keemia põhikooli lõpueksam 2009)
6CO2 + 6H2O → C6H12O6 + 6O2↑
Vastus: 630 g
Lahendus: reaktsioonivõrrandist näeme, et kuue mooli CO2 reageerimisel tekib üks mool glükoosi ehk moolsuhe on 6:1. Teame CO2 ruumala, sellest saame leida selle moolide arvu:
\(n= {V\over V_m} = {470dm^3 \over 22,4dm^3/mol}=21mol\)
Moolsuhte 6:1 järgi teame, et glükoosi tekib moolides kuus korda vähem, seega 21/6 = 3,5 mol. Nüüd saame juba leida glükoosi massi, arvutades esmalt selle molaarmassi.
M(C6H12O6) = 6×12 + 12×1 + 6×16 = 180 g/mol
m = n × M = 3,5 mol × 180 g/mol = 630 g
4.3 Autode turvapadjad sisaldavad naatriumasiidi (NaN3) ja kaaliumnitraati. Avarii korral käivitab sensor järgmise reaktsiooni:
10NaN3 + 2KNO3 → 5Na2O + K2O + 16N2↑
Mitu dm3 (nt.) lämmastikku moodustub avarii korral, kui turvapadi sisaldab 175 g naatriumasiidi? (Keemia põhikooli lõpueksam 2012)
Vastus: 96,3 dm3
Lahendus: esmalt leiame naatriumasiidi moolide arvu:
M(NaN3) = 23 + 3×14 = 65 g/mol
\(n= {m\over M} = {175g \over 65g/mol}=2,7mol\)
Reaktsioonivõrrandi järgi on naatriumasiidi ja tekkiva lämmastiku moolsuhe 10:16. Kuna naatriumasiidi on 2,7 mol, peab lämmastiku moolide arv olema \(16 \over 10\) võrra suurem ehk \(2.7 *{16 \over 10} = 4,3\)mol. Selle leidnuna saame juba leida tekkinud lämmastiku ruumala.
V = n × Vm =2,7 mol × 22, 4dm3/mol = 96,3 dm3
4.4 Kihisevate vitamiinitablettide lahustumisel vees reageerib tablettides sisalduv sidrunhape söögisoodaga (NaHCO3). Ühe pakitäie kihisevate tablettide lahustumisel vees eraldub 6200 ml süsihappegaasi (nt). Mitu grammi sidrunhapet sisaldub pakitäies tablettides? (Keemia põhikooli lõpueksam 2016)
3NaHCO3 + C6H8O7 → Na3C6H5O7 + 3CO2↑ + 3H2O
Vastus: 17,3 g
Lahendus: Süsihappegaasi eraldub 6200 ml = 6,2 l = 6,2 dm3. Sellest saame leida selle moolide arvu:
\(n= {V\over V_m} = {6,2dm^3 \over 22,4dm^3/mol}=0,28mol\)
Reaktsioonivõrrandist näeme, et sidrunhappe ja CO2 moolsuhe on 1:3. Kuna CO2 moolide arv on teada, saab leida, et sidrunhappe moolide arv on 0,28/3 ≈ 0,09 mol. Nüüd saame juba leida sidrunhappe massi, arvutades esmalt selle molaarmassi.
M(C6H8O7) = 6×12 + 8×1 + 7×16 = 192 g/mol
m = n × M = 0,09 mol × 192g/mol ≈ 17,3 g
2.5. Lahuse protsendilise koostise arvutamine
Lahuseid ei saa alati valmistada kaalumise teel. Kuna suur osa lahusest on lahusti, mis tavapäraselt on vedelik, siis on seda otstarbekas mõõta mõõtesilindriga. Kui tahta valmistada kindla massiprotsendiga lahust, on vaja ruumala ümber arvutada massiks. Seda saab teha aine tiheduse abil.
Järgnevast videost saad vaadata, kuidas teisendada ühikuid, kuidas leida aine protsendilist sisaldust lahuses ja lahuse protsendilise koostise kaudu aine ning lahuse massi.
Allikas: https://youtu.be/ZAyQWKmeo6Y
Kordame üle teadmised protsendist.
Lahus koosneb lahustist ja lahustunud ainest, seega
m(lahus) = m(lahusti) + m(lahustunud aine).
Massiprotsent (tähis P) näitab, kui suure osa kogu lahuse massist moodustab lahustunud aine mass:
m(lahus) – 100%
m(aine) – P ;
$P=\frac{m(aine)}{m(lahus)}\times 100%$
Tihedus näitab, kui suur on aine mass ruumalaühiku kohta. Tiheduse valem on $\rho=\frac{m}{V}$, kus ρ tähistab tihedust, m massi ning V ruumala. Tiheduse enim kasutatavaks ühikuks koolikeemias on g/cm3, massi põhiühikuks on g ning ruumala ühikuks on cm3.
Ülesanne 1
Kindlasti jäta meelde, et massiprotsenti tohib arvutada ainult lahuse ja tema komponentide massidest.
Arvutusülesannete lahendamisel võid meeles pidada järgnevad sammud:
- Loe ülesande tekst mõttega läbi.
- Jooni tekstis alla kõik arvud.
- Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel.
- Kirjuta välja andmed ning otsitav suurus.
- Kirjuta välja valemid ja kui vaja, avalda valemist otsitav suurus.
- Asenda valemitesse arvud ning arvuta.
Ole valmis, et mõnikord tuleb ühikuid teisendada.
Näitena on toodud 3 erinevat ülesannet.
Näidisülesanne 1. Lahuse protsendilise koostise arvutamine
|
1. Loe ülesande tekst mõttega läbi. |
Arvuta väävelhappe protsendiline sisaldus lahuses, kui 200 cm3 lahust (ρ = 1,329 g/cm3) sisaldab 51,6 grammi väävelhapet. |
|
2. Jooni alla kõik arvud tekstis. |
Arvuta väävelhappe protsendiline sisaldus lahuses, kui 200 cm3 lahust (ρ = 1,329 g/cm3) sisaldab 51,6 grammi väävelhapet. |
|
3. Omista arvudele kindlad füüsikalised suurused. |
200 cm3 on lahuse ruumala, 1,329 g/cm3 on lahuse tihedus ning 51,6 g on aine mass. |
|
4. Kirjuta välja andmed, mis on olemas ja mida otsitakse. |
V(lahus) = 200 cm3 ρ(lahus) = 1,329 g/cm3 m(aine) = 51,6 g P = ? |
|
5. Kirjuta välja valemid. |
$P=\frac{m(aine)}{m(lahus)}\times 100%$ $\rho=\frac{m}{V}$ Kuna m(aine) teada, kuid m(lahus) pole teada, saame viimase leida lahuse tihedust ja ruumala kasutades. Selleks avaldame tiheduse põhivalemist massi: m = ρ×V |
|
6. Asenda arvud ja arvuta. |
Kõigepealt arvutame kogu lahuse massi: m = ρ×V = 1,329 g/cm3 × 200 cm3 = 265,8 g Seejärel saame arvutada lahuse massiprotsendi: m(lahus) – 100% m(aine) – P 265,8 g – 100% 51,6 g – P $P =\frac{51,6g\times 100%}{265,8g}\approx 19%$ |
Ülesande 2 lahenused
2.1 Arvuta lahustunud aine protsendiline sisaldus, kui 250 cm3 lahust (ρ=1,21 g/cm3) sisaldab 84,7 grammi väävelhapet. (Anna vastus täisarvuna)
Vastus: 28%
Lahendus: Teada on Vlahus = 250 cm3, ρ=1,21 g/cm3 ja mH2SO4 = 84,7 g. Väävelhappe protsendilise koostise ehk massiprotsendi leidmiseks peame teadma lahuse kogumassi. Leiame selle lahuse ruumala ja tiheduse järgi:
m=Vlahus × ρ = 250 cm3 × 1,21 g/cm3 = 302,5 g
Teades lahustunud aine massi ja lahuse kogumassi, leiame massiprotsendi.
\(P = {m_{aine} \over m_{lahus}} * 100 = {84.7 g\over 302.5g }*100 = 28 \)%
2.2 Ema keetis õunakompotti. Siirupi tegemiseks lahustas ta 3 liitris vees pool kilo suhkrut. Arvuta suhkru massiprotsent saadud lahuses. (Anna vastus täisarvuna)
Vastus: 14%
Lahendus: meil on teada msuhkur = 0,5 kg, vee ruumala Vvesi = 3 l. Massiprotsendi leidmiseks tuleb leida lahuse kogumass, mlahus = msuhkur + mvesi. Vee massi saame ruumala järgi arvutada (ρvesi on alati 1 kg/dm3):
mvesi = Vvesi × ρvesi = 3 dm3 × 1 kg/dm3 = 3 kg
Järgmisena leiame lahuse kogumassi:
mlahus = msuhkur + mvesi = 0,5 + 3 = 3,5 kg
Nüüd saab arvutada suhkru massiprotsendi lahuses:
\(P = {m_{suhkur} \over m_{lahus}} * 100 = {0.5 kg\over 3.5kg }*100 ≈ 14 \)%
2.3 500 g Kellukese joogis sisaldub 0,13 mol suhkrut C12H22O11, mitme %-lise suhkrulahusega on tegemist? (Esita vastus täisarvuna)
Vastus: 9%
Lahendus: Teada on nsuhkur = 0,13 mol, mlahus = 500 g ja suhkru brutovalem. Massiprotsendi leidmiseks on vaja leida suhkru mass, arvutades esmalt selle molaarmassi:
M(C12H22O11) = 12×12 + 22×1 + 11×16 = 342 g/mol
m = n × M = 0,13 mol × 342g/mol = 44,5 g
Nüüd saab leida suhkru massiprotsendi joogis:
\(P = {m_{suhkur} \over m_{lahus}} * 100 = {44.5g\over 500g }*100 ≈ 9 \)%
2.4 Selleks, et Kellukese jook ei tunduks väga magus lisatakse sellele sidrunhapet, 1l Kellukese jooki sisaldab 1,8 g sidrunhapet, Kellukese joogi tihedus on 1,012 g/cm3. Mis on sidrunhappe protsent Kellukeses? (Anna vastus täpsusega üks koht peale koma)
Vastus: 0.2%
Lahendus: Teada on Vlahus = 1 l, msidrunhape = 1,8 g, ρlahus = 1,012 g/cm3. Massiprotsendi leidmiseks on vaja teada lahuse massi, mille saab ruumala ja tiheduse järgi arvutada, teisendame esmalt liitrid kuupsentimeetriteks:
Vlahus = 1 l = 1 dm3 = 1000 cm3
mlahus = Vlahus × ρlahus = 1000 cm3 × 1,012 g/cm3 = 1012 g
Nüüd saab leida sidrunhappe massiprotsendi joogis:
\(P = {m_{sidrunhape} \over m_{lahus}} * 100 = {1.8g\over 1012g }*100 ≈ 0.2 \)%
Näidisülesanne 2. Lahustunud aine massi arvutamine
| Loe ülesande tekst mõttega läbi. | Kui palju on 500 cm3 20% lahuses soola, kui lahuse tihedus on 1,43 g/cm3? |
| Andmed: |
V(lahus) = 500 cm3 P = 20% ρ(lahus) = 1,43 g/cm3 m(aine) =? |
| Valemid: |
m(lahus) – 100% m(aine) – P Kuna pole teada ei aine ega lahuse massi, kuid on antud lahuse tihedus ja ruumala, saame leida lahuse massi: m = ρ×V |
| Arvutused: |
Kõigepealt leiame kogu lahuse massi: m = ρ × V= 1,43 g/cm3 × 500 cm3 = 715 g Seejärel saame leida juba lahustunud aine massi: m(lahus) – 100% m(aine) – P 715 g – 100% m(aine) – 20% $m(aine)=\frac{715\times 20%}{100%}=143g$ |
Ülesande 3 lahendused
3.1 Glükoosi 5%-list lahust (tihedus 1,0175 g/cm3) kasutatakse süsivesikute- ja vedelikupuuduse raviks. Soovitatav annus täiskasvanud inimesel veenisisesel manustamisel on 500 ml lahust 3 tunni jooksul. Mitu grammi on selle glükoosilahuse mass? Esita vastused täisarvuna.
Vastus: 509 g
Mitu grammi glükoosi see lahus sisaldab? (Keemia põhikooli lõpueksam 2013)
Vastus: 25 g
Lahendus: Teades glükoosilahuse tihedust ja ruumala, saame leida selle massi:
m = Vlahus × ρ = 500 cm3 × 1,0175 g/cm3 = 508,75 ≈ 509 g
Lisaks on teada, et lahus sisaldab 5% glükoosi, seega massiprotsent P = 5%. Selle abil saame leida lahuses oleva glükoosi massi, sest oleme leidnud lahuse kogumassi.
\(m_{glükoos} = {m_{lahus}*P \over 100} = {509g*5\over 100 } = 25.45 ≈25g\)
3.2 Kurkide soolamiseks kasutatakse 8%-list soolvett. Mitu grammi soola ja mitu liitrit vett tuleb võtta, et valmistada 5 kg sellist soolvett (vee tihedus on 1 g/cm3)?
Vastus: 400 g soola; 4600 g vett ehk 4,6 l vett
Lahendus: Meil on teada soola massiprotsent P = 8% ja soolvee kogumass m = 5 kg = 5000 g. Nende abil saame leida soola massi lahuses:
\(m_{sool} = {m_{lahus}*P \over 100} = {5000g*8\over 100 } = 400g\)
Vee massi saame leida nii, et lahutame soolvee massist selles sisalduva soola massi:
mvesi = mlahus - msool = 5000 g- 400 g= 4600 g
Kuna aga küsitakse veehulka liitrites, peame leidma selle ruumala. Kuna oleme leidnud vee massi ja ülesandes on antud ka vee tihedus, saame selle arvutada.
\(V = {m \over ρ} = {4600g*8\over 1g/{cm}^3 } = 4600 cm^3 = 4.6 dm^3 = 4.6l\)
3.3 Domino küpsise pakis on 175 g küpsiseid, mis sisaldavad kokku 0,2% piimapulbrit. Arvuta mitu grammi piimapulbrit sisaldub ühes pakis Domino küpsites. (Anna vastus täpsusega kaks kohta pärast koma)
Vastus: 0,35 g
Lahendus: Antud on küpsiste kogumass m = 175 g ja piimapulbri massiprotsent P = 0,2%. Saame piimapulbri massi arvutada järgmise valemiga:
\(m_{piimapulber} = {m_{küpsised}*P_{piimapulber} \over 100} = {175g*0.2\over 100 } = 0.35g\)
3.4 Üks Kinderi Maxi Kingi batoon 35 g sisaldab 19 % rasvasid. Mitu grammi rasva sisaldab üks batoon? Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 6,65 g
Lahendus: Sarnaselt eelmisele ülesandele on antud batooni kogumass m = 35 g ja rasvade massiprotsent P = 19%. Neid teades leiame rasvade massi batoonis:
\(m_{rasv} = {m_{batoon}*P_{rasv} \over 100} = {35g*19\over 100 } = 6.65g\)
Näidisülesanne 3. Lahuse ruumala arvutamine
| Loe ülesande tekst mõttega läbi. | 52,4 grammi naatriumhüdroksiidi lahustumisel vees saadi 16%-line lahus (ρ = 1,09 g/cm3). Arvuta lahuse ruumala. |
| Andmed: |
m(aine) = 52,4 g P = 16% ρ(lahus) = 1,09 g/cm3 V(lahus) = ? |
| Valemid ja arvutused: |
$P=\frac{m(aine)}{m(lahus) }\times 100%$ $\rho=\frac{m}{V}$ Kuna teada on aine mass ja protsendiline sisaldus, saame leida kohe kogu lahuse massi ning seejärel tiheduse põhivalemist avaldada lahuse ruumala: $V=\frac{m}{\rho }$ Kogu lahuse mass m(lahus) – 100% Lahustunud aine mass 52,4 g – 16% $m(lahus) =\frac{52,4\times 100%}{16%}= 327,5\ g$ Seejärel leiame lahuse ruumala: $V(lahus)=\frac{327,5\ g}{1,09\ g/cm^{3}}= 300,5\ cm^{3}$ |
Ülesande 4 lahendused
4.1 Želatiini kasutatakse tarretise tegemiseks. Selleks lahustatakse želatiin kuumas vees, segatakse maitse- ja värvainetega ning saadud segu jahutatakse. Tugeva tarretise saamiseks peab segu želatiinisisaldus olema 3%. Tarretise valmistamiseks võeti kuus teelusikatäit želatiini. Mitu grammi vett oli vaja võtta, kui üks teelusikatäis želatiini kaalub 5 grammi? Anna vastus täisarvuna. (Keemia põhikooli lõpueksam 2021)
Vastus: 970 g vett
Lahendus: Meil on teada želatiini massiprotsent P = 3% ja võetud želatiini kogus. Seda võeti kuus teelusikatäit, kusjuures iga teelusikatäis kaalub 5 g, seega võetud želatiini mass on mž = 6×5 = 30 g. Leida tuleb vee mass tarretisesegus, kuid selle leidmiseks on esmalt vaja leida segu kogumass. Seda saab želatiini massi ja massiprotsendi abil teha:
\(m_{segu} = {m_{ž} \over P_ž} = {30g\over 0.03 } = {30g*100\over 3 } = 1000g\)
Nüüd saame leida vee massi segus, sest saame kogumassist želatiini massi maha lahutada:
mvesi = msegu - mž = 1000 g - 30 g = 970 g
4.2 Sool jõudis Tallinnasse peamiselt Prantsusmaalt, Portugalist ja Saksamaalt. Saksamaa tähtsaim soolatootmise keskus oli Lüneburg. Seal eraldati sool maapõuest välja pumbatud looduslikust suure soolasisaldusega veest. Lüneburgi soolvesi (ρ = 1,20 g/cm3) sisaldab 26,3% keedusoola.
a. Arvatakse, et keskajal tarbis üks inimene keskmiselt 6 kg soola aastas. Mitu kilogrammi Lüneburgi soolvett sisaldab sellise koguse soola? Anna vastus täpsusega üks koht pärast koma.
Vastus: 22,8 kg
b. Mitu liitrit on selle soolvee ruumala? Anna vastus täisarvuna. (Keemia põhikooli lõpueksam 2021)
Vastus: 19 l
Lahendus:
a. Antud on soola mass ms = 6 kg ja soola massiprotsent vees, P = 26,3%. Nende abil saab leida soolvee kogumassi:
\(m_{soolvesi} = {m_{sool} \over P_{sool}} = {6kg\over 0.263 } = {6kg*100\over 26.3 } ≈ 22.8kg\)
b. Ülesandes on antud ka soolvee tihedus, ρ = 1,20 g/cm3 = 1,20 kg/dm3. Kuna teame nüüd soolvee massi, saame ruumala nende kahe suuruse kaudu leida:
\(V = {m \over ρ} = {22.8kg*8\over 1.2kg/{dm}^3 } = 19 dm^3 = 19l\)
4.3 Surnumeri on maailma üks soolasemaid veekogusid. Wikipedia andmetel on Surnumere vee keskmine soolasisaldus 31,5% ja tihedus 1,24 kg/dm3.
Mitu kilogrammi Surnumere vett tuleb võtta, et aurustumise tulemusena saada kätte täpselt 1000 g soola? Anna vastus täisarvuna.
Vastus: 3175 g Surnumere vett
Mitu liitrit on selle veekoguse ruumala? Anna vastus täpsusega kaks kohta pärast koma. (Keemia põhikooli lõpueksam 2010)
Vastus: 2,56 l
Lahendus: Surnumere vee massi leidmisel on meile abiks soola mass ms = 1000 g ja soola massiprotsent P = 31,5%. Neist saame leida merevee massi:
\(m_{soolvesi} = {m_{sool} \over P_{sool}} = {1000g\over 0.315 } = {1000g*100\over 31.5 } = 3175g\)
Selle veekoguse ruumala leidmisel on meile abiks ülesandes antud merevee tihedus ρ = 1,24 kg/dm3. Lisaks on just arvutatud merevee mass. Nende abil leiame ruumala:
\(V = {m \over ρ} = {3.175kg*8\over 1.24kg/{dm}^3 } = 2.56 dm^3 = 2.56l\)
4.4 Kelluke sisaldab 100 ml (ρ = 1,034 g/cm3) joogis 8% suhkrut. Anna vastused täpsusega kaks kohta pärast koma.
a. Mitu grammi suhkrut on pooles liitris Kellukese joogis?
Vastus: 41,36 g suhkrut
b. Mitu liitrit vett on 500 ml Kellukeses?
Vastus: 0,48 l vett
Lahendus:
a. Küsitakse suhkru massi Kellukese joogis, mille ruumala V = 0,5 l = 500 ml. Meil on teada suhkru massiprotsent P = 8%, kuid mitte lahuse kogumass, mida on suhkru massi leidmiseks vaja tead Kuna on aga teada joogi tihedus ρ = 1,034 g/cm3, saame selle kogumassi leid
m = Vlahus × ρ = 500 cm3 × 1,034 g/cm3 = 517 g
Suhkru massiprotsendi ja joogi massi kaudu saame leida suhkru massi:
\(m_{suhkur} = {m_{lahus}*P \over 100} = {517g*8\over 100 } = 41.36g\)
b. Olemasolevate andmete põhjal ei saa kohe arvutada vee ruumala, küll aga saame leida vee massi, millest hiljem ruumala arvutada. Teame joogi kogumassi ja selles sisalduva suhkru massi, nii et vee mass on:
mvesi = mlahus - msuhkur = 517 g - 41,36 g = 475,64 g
Eeldame, et tegemist on standardtingimustega, mille korral vee tihedus ρ = 1 g/cm3. Nüüd saame juba leida vee ruumala:
\(V = {m \over ρ} = {475.64g\over 1g/{cm}^3 } = 475.64cm^3=0.47564 dm^3 ≈ 0.48l\)
2.6. Lahuse molaarse kontsentratsiooni arvutamine
Nagu sa juba varasematest peatükkidest oled lugenud, on keemias üks põhilisi suurusi ainehulk, mida kasutatakse erinevates arvutustes. Ainehulga kaudu saame reaktsioonivõrrandite põhjal arvutada, kui palju ainet reageerib või tekib. Samas tegeldakse keemias väga palju lahustega, mida saame mõõta ruumalaühikutes: cm3, dm3, m3. Sellest tulenevalt ongi keemias üks peamisi kasutusel olevaid lahuse kontsentratsiooni väljendusviise molaarsus ehk molaarne kontsentratsioon. Järgnevast videost saad vaadata, kuidas molaarset kontsentratsiooni arvutatakse, kuidas kasutatakse molaarset kontsentratsiooni ainehulga või siis lahuse ruumala leidmiseks ja reaktsioonivõrrandiga arvutusülesannetes.
Allikas: https://youtu.be/Yykk-G7ww1A
Molaarsus näitab lahustunud aine hulka moolides ühes liitris lahuses.
Molaarsus näitab lahustunud aine hulka moolides ühes liitris lahuses ja seda tähistatakse tähega c:
$c=\frac{n}{V}$.
Võrrandis on n ainehulk (ühik mool, lühend mol) ja V on lahuse ruumala (ühik dm3). Molaarsuse ühikuks on mol/dm3 või lühendina M. Jäta meelde, et V on kogu lahuse ruumala. Kirjaviis 0,5 M lahus tähendab, et 1 liitris (dm3) lahuses sisaldub 0,5 mooli lahustunud ainet. Molaarsuse arvutamiseks on vaja teada ainehulka n ja lahuse ruumala V. Toome ära põhilised valemid, mida võib veel vaja minna.
Ainehulga arvutamise valemid:
$n=\frac{m}{M}$
n - ainehulk (ühik mool, lühend mol)
m - aine mass (ühik gramm)
M - molaarmass (ühik g/mol)
$n=\frac{N}{N_{A}}$
N - osakeste arv (ühik osakene)
NA - Avogadro arv, mille väärtus on 6,02 × 1023 osakest/mol
$n=\frac{V}{V_{m}}$
V - aine ruumala (ühik dm3)
Vm - molaarruumala (väärtus 22,4 dm3/mol normaaltingimustel)
Tiheduse kaudu lahuse ruumala arvutamine:
$V=\frac{m}{\rho}$
m - kogu lahuse mass, m(lahus) = m(aine) + m(lahusti) (ühik gramm)
ρ - lahuse tihedus (ühik g/cm3).
Näidisülesanne 1. Molaarse kontsentratsiooni arvutamine
| 1. Loe ülesande tekst mõttega läbi. | 250 cm3 lahust sisaldab 10 g NaOH-d. Arvuta lahuse molaarne kontsentratsioon. |
| 2. Jooni tekstis alla kõik arvud. |
Arvuta 250 cm3 lahust sisaldab 10 g NaOH-d. Arvuta lahuse molaarne kontsentratsioon. |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 250 cm3 on lahuse ruumala, 10 g on aine mass. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
V(lahus) = 250 cm3 m(aine) = 10 g c = ? |
|
5. Kirjuta välja valemid ning vajadusel avalda valemist otsitav suurus. |
$c=\frac{n}{V}$ Ainehulga saad arvutada valemist $n=\frac{m}{M}$ |
| 6. Asenda valemitesse arvud ning arvuta. |
Ainehulga arvutamiseks leia kõigepealt NaOH molaarmass: M(NaOH) = 23 + 1 + 16 = 40 g/mol $n=\frac{m}{M}=\frac{10g}{40g/mol}=0,25mol$ Molaarse kontsentratsiooni valemis peab lahuse ruumala olema dm3: V(lahus) = 250 cm3 = 0,250 dm3 $c=\frac{n}{V}=\frac{0,25\ mol}{0,25\ dm^{3}}=1\frac{mol}{dm^{3}}=1M$ |
Ülesande 1 lahendused
1.1 Arvuta lahuse molaarne kontsentratsioon, kui 1,50 l lahusesse on lisatud 1,45 mol KCl. Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,97 M
Lahendus: Teada on ruumala V = 1,50 l ja moolide arv n = 1,45 mol. Neist saame arvutada molaarse kontsentratsiooni c:
\(c = {n \over V}={1.45 mol \over 1.50l}≈0,97 M\)
1.2 Arvuta lahuse molaarne kontsentratsioon, kui 10 ml lahusesse on lisatud 5,65 mmol Br2. Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,57 M
Lahendus: Teada on ruumala V = 10 ml ja moolide arv n = 5,65 mmol. Neist saame arvutada molaarse kontsentratsiooni c:
\(c = {n \over V}={5.65mmol \over 10ml}={5.65mol \over 10l}≈0,57 M\)
1.3 Arvuta lahuse molaarne kontsentratsioon, kui 1575 l lahusesse on lisatud 20,54 kg Al(NO3)3. Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,06 M
Lahendus: Teada on ruumala V = 1575 l ja aine mass m = 20,54 kg. Molaarse kontsentratsiooni leidmiseks tuleb esmalt arvutada moolide arv n:
M[Al(NO3)3] = 213 g/mol
\(n = {m \over M}={20540g \over 213g/mol}=96.43mol\)
Nüüd saab leida molaarse kontsentratsiooni c:
\(c = {n \over V}={96.43mol \over 1575l}≈0,06 M\)
1.4 Arvuta lahuse molaarne kontsentratsioon, kui 1 l lahust sisaldas 0,515 g väävelhapet. Anna vastus täpsusega kolm kohta pärast koma.
Vastus: 0,005 M
Lahendus: Teada on ruumala V = 1 l ja aine mass m = 0,515 g. Molaarse kontsentratsiooni leidmiseks tuleb esmalt arvutada moolide arv n:
M(H2SO4) = 98 g/mol
\(n = {m \over M}={0.515g \over 98g/mol}=0.005mol\)
Nüüd saab leida molaarse kontsentratsiooni c:
\(c = {n \over V}={0.005mol \over 1l}=0,005 M\)
1.5 1 l piimas on 1,0 g Ca2+ ioone. Mis on Ca2+ molaarne kontsentratsioon piimas? Anna vastus täpsusega kolm kohta pärast koma.
Vastus: 0,025 M
Lahendus: Teada on ruumala V = 1 l ja Ca2+ ioonide mass m = 1,0 g. Molaarse kontsentratsiooni leidmiseks tuleb esmalt arvutada moolide arv n:
M(Ca2+) = 40 g/mol
\(n = {m \over M}={1.0g \over 40g/mol}=0.025mol\)
Nüüd saab leida molaarse kontsentratsiooni c:
\(c = {n \over V}={0.025mol \over 1l}=0,025 M\)
Näidisülesanne 2. Lahuse ruumala arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Mitu ml 3,5 M soolhappe lahust tuleb võtta, et see sisaldaks 5 g puhast HCl-i? |
| 2. Jooni tekstis alla kõik arvud. | Mitu ml 3,5 M soolhappe lahust tuleb võtta, et see sisaldaks 5 g puhast HCl-i? |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 3,5 M on lahuse molaarsus, 5 g on puhta HCl mass. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
c = 3,5 M m(aine) = 5 g V(lahus) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda otsitav suurus. |
$c=\frac{n}{V}$
Avalda valemist lahuse ruumala $V=\frac{n}{c}$. |
| 6. Asenda valemitesse arvud ning arvuta. |
M(HCl) = 1+ 35,5 = 36,5 g/mol $n=\frac{m}{M}=\frac{5\ g}{36,5\ g/mol}=0,14\ mol$ $V=\frac{n}{c}=\frac{0,14\ mol}{3,5\ mol/dm^{3}}=0,04\ dm^{3}=40\ cm^{3}(ml)$ |
Ülesande 2 lahendused
2.1. 1,0 M Fe(NO3)3 lahus sisaldab 10 g ainet. Arvuta lahuse ruumala milliliitrites. Anna vastus täisarvuna.
Vastus: 41 ml
Lahendus: Teada on aine mass m = 10 g ja selle molaarne kontsentratsioon c = 1,0 M. Kui kontsentratsioon on teada, siis ruumala leidmiseks on veel vaja teada moolide arvu. Seda saab Fe(NO3)3 massi abil leida:
M[Fe(NO3)3] = 242 g/mol
\(n = {m \over M}={10g \over 242g/mol}=0.041mol\)
Nüüd saab leida lahuse ruumala V:
\(V = {n \over c}={0.041mol \over 1.0M}=0.041l =41ml\)
2.2. 1,22 M lahuse lahjendamisel saadi 0,17 liitrit 0,36 M C3H7OH lahust. Arvuta esialgse lahuse ruumala? Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,050 l
Lahendus: Lahuste lahjendamise ülesannetes on abiks asjaolu, et lahjendamisel lisatakse lahustit, kuid aine (selles ülesandes C3H7OH) moolide arv n jääb mõlemas lahuses samaks. Seega tuleb leida moolide arv lõpplahuses ja hiljem selle alusel arvutada alglahuse ruumala.
Lõpplahuse andmed on teada: Vlõpp = 0,17 l, clõpp = 0,36 M; leiame moolide arvu n:
n = Vlõpp × clõpp = 0,17 l × 0,36 M = 0,0612 mol
Kuna see on moolide arv ka alglahuses, saame nüüd arvutada esialgse lahuse ruumala:
\(V_{alg} = {n \over c_{alg}}={0.0612mol \over 1.22M}=0.05l \)
2.3. 15 mg Na2SO4 sisaldus 0,6 M lahuses. Kui suur on lahuse ruumala milliliitrites? Anna vastus täpsusega kolm kohta pärast koma.
Vastus: 0,176 ml
Lahendus: Teada on kontsentratsioon c = 0,6 M ja aine mass m = 15 mg. Lahuse ruumala leidmiseks tuleb esmalt arvutada moolide arv n:
M(Na2SO4) = 142 g/mol = 142 mg/mmol
\(n = {m \over M}={15mg \over 142g/mol}=0.1056mmol\)
Nüüd saab leida lahuse ruumala V:
\(V = {n \over c}={0.1056mmol \over 0.6mmol/ml}=0.176ml \)
2.4. Mitmes ml lahuses peaks lahustama 250 kg NaNO3, et lahuse kontsentratsioon oleks 5 M? Anna vastus täisarvuna.
Vastus: 588235 ml
Lahendus: Teada on NaNO3 mass m = 250 kg ja soovitav kontsentratsioon c = 5 M. Lahuse ruumala leidmiseks tuleb jällegi esmalt arvutada moolide arv n:
M(NaNO3) = 85 g/mol
\(n = {m \over M}={250000g \over 85g/mol}=2941.1765mol\)
Nüüd saab leida lahuse ruumala V:
\(V = {n \over c}={2941.1765mol \over 5M}=588.235l=588235ml\)
Näidisülesanne 3. Ainehulga arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Mitu mooli väävelhapet sisaldub 500 ml 0,15 M H2SO4 lahuses? |
| 2. Jooni tekstis alla kõik arvud. | Mitu mooli väävelhapet sisaldub 500 ml 0,15 M H2SO4 lahuses? |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 500 ml on kogu lahuse ruumala, 0,15 M on lahuse molaarne kontsentratsioon. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
V(lahus) = 500 ml c = 0,15 M n(H2SO4) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. | Lahuse molaarsest kontsentratsioonist saame avaldada otsitava suuruse, ainehulga n = c × V. |
| 6. Asenda valemitesse arvud ning arvuta. |
Teisenda lahuse ruumala dm3-teks V(lahus) = 500 ml = 0,5 dm3 n = c × V = 0,15 mol/dm3 × 0,5 dm3 = 0,075 mol |
Ülesande 3 lahendused
3.1. Mitu mooli ja mitu grammi ammooniumsulfaati sisaldub 150 cm3 0.5 M (NH4)2SO4 lahuses? Vastust ära ümarda.
Vastus: 0,075 mol ja 9,9 g
Lahendus: Teada on ruumala V = 150 cm3 ja kontsentratsioon c = 0,5 M. Neist saame arvutada moolide arvu n:
n = V × c = 0,15 dm3 × 0,5 M = 0,075 mol
Seda teades saab arvutada (NH4)2SO4 massi:
M[(NH4)2SO4] = 132 g/mol
m = n × M = 0,075 mol × 132 g/mol = 9,9 g
3.2. Kui suur on ainehulk, mis on lahustatud 25 ml 0,4 mol/dm3 lahuses?
Vastus: 0,01 mol
Lahendus: Teada on ruumala V = 25 ml ja molaarne kontsentratsioon c = 0,4 mol/dm3. Neist saame arvutada ainehulga n:
n = V × c = 25 cm3 × 0,4 mol/dm3 = 0,025 dm3 × 0,4 mol/dm3 = 0,01 mol
3.3. Mitu mooli väävelhapet on 2 l 18,5 M väävelhappe lahuses?
Vastus: 37 mol
Lahendus:Teada on ruumala V = 2 l ja molaarne kontsentratsioon c = 18,5 M. Neist saame arvutada moolide arvu n:
n = V × c = 2 l × 18,5 mol/l = 37 mol
3.4. Mitu mooli FeSO4 on 325 ml 1,8 × 10−6 M FeSO4 lahuses? Vastust ära ümarda.
Vastus: 0,000000585 mol
Lahendus: Teada on lahuse ruumala V = 325 ml ja molaarne kontsentratsioon c = 1,8×10−6 M. Neist saame arvutada moolide arvu n:
n = V × c = 0,325 l × 1,8 × 10-6 mol/l = 0,000000585 mol
Näidisülesanne 4. Ioonide kontsentratsioonide arvutamine
| 1. Loe ülesande tekst mõttega läbi. | CaCl2 on tugev elektrolüüt ning dissotsieerub täielikult. 50 ml CaCl2 lahuses oli lahustatud 0,2 mol CaCl2. Arvuta lahusesse tekkinud Ca2+ ja Cl- ioonide kontsentratsioon lahuses. |
| 2. Jooni tekstis alla kõik arvud. | CaCl2 on tugev elektrolüüt ning dissotsieerub täielikult. 50 ml CaCl2 lahuses oli lahustatud 0,2 mol CaCl2. Aruta lahusesse tekkinud Ca2+ ja Cl- ioonide kontsentratsioon lahuses. |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 50 ml on kogu lahuse ruumala, 0,2 mol on lahuses sisalduv CaCl2 aine hulk. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
V(lahus) = 50 ml n = 0,2 mol c(Ca2+) =? c(Cl-) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. | $c=\frac{n}{V}$ |
| 6. Asenda valemitesse arvud ning arvuta. |
Kirjutame välja dissotsiatsioonivõrrandi: CaCl2 → Ca2+ + 2 Cl- Võrrandist on näha, et ühe mooli CaCl2 dissotsieerumisel tekib 1 mool Ca2+ ja 2 mooli Cl-. Ülesande alusel lisati lahusesse 0,2 mooli soola, seega saab tekkida 1 $\times $ 0,2 mooli Ca2+ ja 2 $\times $ 0,2 mooli Cl-. Enne molaarse kontsentratsiooni arvutamist teisendame lahuse ruumala. V(lahus) = 50 ml = 0,05 dm3 $c(Ca^{2+})=\frac{n}{V}=\frac{0,2\ mol}{0,05\ dm^{3}}=4\frac{mol}{dm^{3}}=4M$ $c(Cl^{-})=\frac{n}{V}=\frac{0,4\ mol}{0,05\ dm^{3}}=8\frac{mol}{dm^{3}}=8M$ |
Ülesande 4 lahendused
4.1. 500 ml lahusesse oli lisatud 0,2 mol CaCl2 ja 0,7 mol HCl. Arvuta kloriidioonide ja vesinikioonide kontsentratsioon lahuses. Anna vastus täpsusega üks koht pärast koma.
Vastus: 2,2 M; 1,4 M
Lahendus: Teada on lahuse ruumala V = 500 ml, CaCl2 moolide arv n(CaCl2) = 0,2 mol ja HCl moolide arv n(HCl) = 0,7 mol. Vaja on leida c(Cl-) ja c(H+).
Kirjutame välja kummagi ühendi dissotsiatsioonivõrrandid:
1) CaCl2 → Ca2+ + 2Cl-
2) HCl → H+ + Cl-
Võrrandist 1) näeme, et 1 mooli CaCl2 dissotsieerumisel tekib 2 mooli kloriidioone. Seega tekib 0,2 mol CaCl2 dissotsiatsioonil 2×0,2 = 0,4 mol kloriidioone.
Võrrandi 2) põhjal saame öelda, et HCl dissotsiatsioonil tekib 1×0,7 = 0,7 mol kloriidioone. Vesinikioone tekib sama palju, seega n(H+) = 0,7 mol.
Kloriidioone on kokku n(Cl-) = 0,4 + 0,7 = 1,1 mol.
Ioonide ainehulki teades saame arvutada nende kontsentratsioonid lahuses.
\(c(Cl^-)={n \over V}={1.1mol \over 0.5l}=2.2M\)
\(c(H^+)={n \over V}={0.7mol \over 0.5l}=1.4M\)
4.2. Arvuta fosfaatioonide ja kaaliumioonide ainehulk ning molaarne kontsentratsioon 200 ml 0,4 M kaaliumfosfaadi täielikul dissotsiatsioonil. Lõppvastuseid ära ümarda.
Vastus: 0,24 mol; 1,2 M; 0,08 mol; 0,4 M
Lahendus: Teada on lahuse ruumala V = 200 ml ja K3PO4 molaarne kontsentratsioon c(K3PO4) = 0,4 M. Neist saame leida K3PO4 moolide arvu:
n = V × c = 0,2 l × 0,4 mol/l = 0,08 mol
Kirjutame välja K3PO4 dissotsiatsioonivõrrandi:
K3PO4 → 3K+ + PO43-
Võrrandist näeme, et dissotsiatsioonil tekkivate kaaliumioonide moolide arv on kolm korda suurem kui dissotsieerumata soola ja fosfaatioonide omad. Seega n(K+) = 3×0,08 = 0,24 mol ja n(PO43-) = 0,08 mol.
Ainehulki teades saame leida ka ioonide molaarsed kontsentratsioonid:
\(c(K^+)={n \over V}={0.24mol \over 0.2l}=1.2M\)
\(c(PO^{-3}_4)={n \over V}={0.08mol \over 0.2l}=0.4M\)
4.3. Arvuta kui palju bromiidioone ja magneesiumi ioone tekib 400 ml 0,15 M magneesiumbromiidi täielikul dissotsieerumisel. Anna vastus ühe koma koha täpsusega.
Vastus: N(Mg2+)= 3,6 × 1022, N(Br−)= 7,2 × 1022
Lahendus: Teada on lahuse ruumala V = 400 ml ja MgBr2 molaarne kontsentratsioon c(MgBr2) = 0,15 M. Neist saame leida MgBr2 moolide arvu:
n = V × c = 0,4 l × 0,15 mol/l = 0,06 mol
Kirjutame välja MgBr2 dissotsiatsioonivõrrandi:
MgBr2 → Mg2+ + 2Br–
Võrrandist näeme, et dissotsiatsioonil tekkivate kloriidioonide moolide arv on kaks korda suurem kui dissotsieerumata soola ja magneesiumioonide omad. Seega n(Mg2+) = 1×0,06 = 0,06 mol ja n(Br–) = 2×0,06 = 0,12 mol.
Osakeste arvu leidmiseks tuleb ainehulgad läbi korrutada Avogadro arvuga NA:
N(Mg2+) = n × NA = 0,06 mol × 6,02 × 1023 aatomit/mol = 3,6×1022
N(Br-) = n × NA = 0,12 mol × 6,02 × 1023 aatomit/mol = 7,2×1022
4.4. 0,250 l lahusesse oli lisatud 0,2 mol väävelhapet ja 0,5 mol alumiiniumsulfaati. Arvuta alumiiniumi ioonide ja sulfaatioonide kontsentratsioon lahuses. Lõppvastuseid ära ümarda.
Vastus: 6,8 M; 4 M
Lahendus: Teada on lahuse ruumala V = 0,25 l, H2SO4 moolide arv n(H2SO4) = 0,2 mol ja Al2(SO4)3 moolide arv n[Al2(SO4)3] = 0,5 mol. Kirjutame välja kummagi ühendi dissotsiatsioonivõrrandid:
1) H2SO4 → 2H+ + SO42–
2) Al2(SO4)3 → 2Al3+ + 3SO42–
Võrrandi 1) järgi näeme, et kui n(H2SO4) = 0,2 mol, siis n(H+) = 2×0,2 = 0,4 mol ja n(SO42–) = 0,2 mol. Võrrandi 2) järgi näeme, et kui n(Al2(SO4)3) = 0,5 mol, siis n(Al3+) = 2×0,5 = 1,0 mol ja n(SO42–) = 3×0,5 = 1,5 mol.
Sulfaatioone on kokku n(SO42–) = 0,2 + 1,5 = 1,7 mol ja alumiiniumiioone n(Al3+) = 1,0 mol. Nüüd saab leida kummagi molaarsed kontsentratsioonid:
\(c(Al^{3+})={n \over V}={1.0mol \over 0.25l}=4M\)
\(c(SO^{2-}_4)={n \over V}={1.7mol \over 0.25l}=6.8M\)
Näidisülesanne 5. Reaktsioonivõrrandi abil ainehulga või ruumala arvutamine
| 1. Loe ülesande tekst mõttega läbi. | Mitu ml 1,5 M H2SO4 lahust on vaja 2 M 15 ml NaOH lahuse neutraliseerimiseks? |
| 2. Jooni tekstis alla kõik arvud. | Mitu ml 1,5 M H2SO4 lahust on vaja 2 M 15 ml NaOH lahuse neutraliseerimiseks? |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 1,5 M on väävelhappe lahuse molaarne kontsentratsioon, 2 M on NaOH lahuse molaarne kontsentratsioon ja 15 ml on NaOH lahuse kogus. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
c(H2SO4) = 1,5 M c(NaOH) = 2 M V(NaOH) = 15 ml = 0,015 dm3 V(H2SO4) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. |
Koostame reaktsioonivõrrandi: 2NaOH + H2SO4 → Na2SO4 + 2H2O Reaktsioonivõrrandi alusel on näha, et 2 mooli NaOH-ga reageerib üks mool H2SO4 . Nüüd vaatame, mitu mooli ainet on antud ülesandes. Moolide arvu arvutame molaarse kontsentratsiooni ja aine ruumala alusel $c=\frac{n}{V}$ ja n(NaOH) = c × V Väävelhappe ruumala arvutamiseks kasutame valemit $V=\frac{n}{c}$ |
| 6. Asenda valemitesse arvud ning arvuta. |
Kirjutame reaktsioonivõrrandi H2SO4 + 2NaOH → Na2SO4 + 2H2O H2SO4 ja NaOH moolsuhe on 1 : 2. Ülesandes antud andmete alusel n(NaOH) = c $\times $ V = 2 mol/dm3 $\times $ 0,015 dm3 = 0,03 mol Järelikult väävelhappe moolide arv on: $n(H_{2}SO_{4})=\frac{1}{2}\times 0,03\ mol=0,015\ mol$ Arvutame väävelhappe ruumala $V(H_{2}SO_{4})=\frac{n}{c}=\frac{0,015\ mol}{1,5\ mol/dm^{3}}=0,01dm^{3}=10cm^{3}(ml)$ |
Ülesande 5 lahendused
5.1. Mitu mooli ja mitu grammi kaaliumnitraati tekib, kui tahkele kaaliumkarbonaadile lisati 30 ml 0,2 M lämmastikhappe lahust?
Vastus: 0,006 mol; 0,6 g
Lahendus: Kirjutame välja ja tasakaalustame reaktsioonivõrrandi:
K2CO3 + 2 HNO3 → 2 KNO3 + CO2 + H2O
Kuna teada on lämmastikhappe lahuse ruumala V = 30 ml ja selle kontsentratsioon c(HNO3) = 0,2 M, saame leida selle moolide arvu n:
n = V × c = 0,03 l × 0,2 mol/l = 0,006 mol
Reaktsioonivõrrandist näeme, et HNO3 ja KNO3 moolsuhe on 1:1. Seega tekib ka KNO3 0,006 mol. Nüüd saame arvutada molaarmassi ja massi:
M(KNO3) = 101 g/mol
m = n × M= 0,006 mol × 101 g/mol = 0,606 g ≈ 0,6 g
5.2. Valati kokku 50 cm3 1,5 M kaaliumhüdroksiid lahust ja 0,035 dm3 2 M fosforhappe lahust. Mitu mooli ja grammi kaaliumfosfaati tekib?
Vastus: 0,025 mol; 5,3 g.
Lahendus: Kirjutame välja ja tasakaalustame reaktsioonivõrrandi:
3 KOH + H3PO4 → K3PO4 + 3 H2O
Olemasolevate andmete põhjal tuleb leida reageerivate kaaliumhüdroksiidi ja fosforhappe ainehulgad.
n(KOH) = VKOH × cKOH = 0,05 l × 1,5 M = 0,075 mol
n(H3PO4) = VH34PO × cH34PO = 0,035 l × 2 M = 0,07 mol
Reaktsioonivõrrandi järgi on KOH ja H3PO4 moolsuhe 3:1, kokku valatud ainehulkade suhe aga 0,075:0,07. Seega on H3PO4 ülehulgas ja arvutused teeme KOH järgi.
Kui 3 mooli KOH reageerimisel tekib 1 mool K3PO4, siis 0,075 mol KOH puhul tekib n=0,075/3=0,025 mol K3PO4. Selle ainehulga massi saab juba leida:
M(K3PO4) = 212 g/mol
m = n × M = 0,025 mol × 212 g/mol = 5,3 g
5.3. Mitu dm3 1,5 M kaaliumhüdroksiidi lahust on vaja võtta, et täielikult neutraliseerida 0,400 dm3 1 M lämmastikhappe lahus? Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,27 dm3
Lahendus: Kirjutame välja ja tasakaalustame reaktsioonivõrrandi:
KOH + HNO3 → KNO3 + H2O
Kuna teada on lämmastikhappe lahuse ruumala V = 0,4 dm3 ja selle kontsentratsioon c(HNO3) = 1 M, saame leida moolide arvu n:
n = V × c = 0,4 l × 1 mol/l = 0,4 mol
Reaktsioonivõrrandi järgi reageerivad KOH ja HNO3 moolsuhtega 1:1, seega on ka KOH moolide arv 0,4 mol. Kuna teame selle molaarset kontsentratsiooni c(KOH) = 1,5 M, saame arvutada KOH lahuse ruumala:
\(V = {n \over c}={0.4mol \over 1.5M}=0.266...≈0.27dm^3\)
5.4. Mitu dm3 0,3 M baariumhüdroksiidi lahust on vaja võtta, et täielikult neutraliseerida 0,25 dm3 0,25 M vesinikkloriidhappe lahus? Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,10 dm3
Lahendus: Kirjutame välja ja tasakaalustame reaktsioonivõrrandi:
Ba(OH)2 + 2 HCl → BaCl2 + 2 H2O
Kuna teada on vesinikkloriidhappe lahuse ruumala V = 0,25 dm3 ja selle kontsentratsioon c(HCl) = 0,25 M, saame leida moolide arvu n:
n = V × c = 0,25 l × 0,25 mol/l = 0,0625 mol
Reaktsioonivõrrandi järgi reageerivad Ba(OH)2 ja HCl moolsuhtega 1:2, seega on ka Ba(OH)2 moolide arv 0,0625/2=0,03125 mol. Kuna teame selle molaarset kontsentratsiooni c[Ba(OH)2] = 0,3 M, saame arvutada KOH lahuse ruumala:
\(V = {n \over c}={0.03125mol \over 0.3M}≈0.10dm^3\)
2.7. Lisandite arvestamine arvutustes
Eri ainete tootmises kasutatakse tihti lähteaineid, mis ei ole täiesti puhtad ehk sisaldavad mingeid lisandeid. Seetõttu tekib protsessi käigus ka vähem saadusi, kui tekiks puhaste ainete korral. Järgnevast videost saad vaadata, kuidas arvestada lisandite mõju erinevates arvutusülesannetes.
Allikas: https://youtu.be/0epwo6KCfbQ
Kui lähteainetes on lisandid, siis puhta aine protsenti lähteainetes saad arvutada protsentarvutuse reegli alusel:
$P(puhas\ aine)=\frac{m(puhas\ aine)}{m(kogu\ aine\ mass\ koos\ lisandiga)}\times 100$
m(puhas aine) on puhta aine mass (ühik g) ja m(kogu aine mass koos lisandiga) on aine mass, mis sisaldab lisandeid (ühik g).
Sarnaselt puhta aine protsendilise sisaldusega on võimalik arvutada ka lisandi sisaldus aines
$P(lisandid)=\frac{m(lisand)}{m(kogu\ aine\ mass\ koos\ lisandiga)}\times 100$
m(lisand) on lisandi mass (ühik g).
Kokku on lähteaine ja lisandi protsent 100%: P(puhas aine) + P(lisand) = 100%
Näidisülesanne 1. Lisandi protsendilise sisalduse arvutamine
| 1. Loe ülesande tekst mõttega läbi. | 150 g vase maaki sisaldab 87,3 g vaske. Arvuta vase ja lisandite protsendiline sisaldus maagis. |
| 2. Jooni tekstis alla kõik arvud. | 150 g vase maaki sisaldab 87,3 g vaske. Arvuta vase ja lisandite protsendiline sisaldus maagis. |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 150 g on kogu maagi mass, mis sisaldab 87,3 g on puhast vaske. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
m(maak) = 150 g m(vask) = 87,3 g P(vask) = ? P(lisand) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. | Lisandi % arvutamisel arvestame, et kogu maak on 100% ja P(lisand) = 100 - P(vask) |
| 6. Asenda valemitesse arvud ning arvuta. |
Puhta vase sisaldus proovis on |
Ülesande 1 lahendused
1.1. Alumiiniumi sisalduse leidmiseks alumiiniumi ja vase sulamist viidi läbi järgmine katse. 7 g sulamile lisati HCl lahust. Kui reaktsioon oli läbi viidud siis väike kogus vaske oli alles jäänud ning reaktsiooni tulemusena oli kokku kogutud 1,32 dm3 vesinikku (nt.).
2Al + 6HCl → 2AlCl3 + 3H2
Mitu mooli HCl reageeris reaktsiooni käigus?
Vastus: 0.118 mol
Mitu mooli Al reageeris ära?
Vastus: 0.039 mol
Mitu grammi Al reageeris ära?
Vastus: 1.06 g
Mitu grammi Cu oli sulamis?
Vastus: 5.94 g
Arvuta lisandi % sulamis.
Vastus: 85%
Lahendus:
Lähtume teadmisest, et H2 tekib 1,32 dm3. Gaaside puhul kehtib konstant Vm = 22,4 dm3/mol, mille abil saab leida moolide arvu n:
\(n={ V\over V_m}={ 1.32dm^3\over 22dm^3/mol} = 0.059mol\)
Reaktsioonivõrrandist näeme, et vesiniku ja HCl moolsuhe on 3:6=1:2. Seega oli reageeriva HCl moolide arv n(HCl)= 0,059×2=0,118 mol.
HCl ja alumiiniumi moolsuhe on aga 6:2=3:1, mis tähendab, et alumiiniumi moolide arv n(Al)=0,118/3=0,039 mol.
Nüüd saame leida alumiiniumi massi, teades, et M(Al)=27 g/mol:
m = n × M = 0,039 mol × 27 g/mol = 1,053 g ≈ 1,05 g
Vase mass sulamis on seega 7–1,05=5,95 g.
Lisandi ehk vase sisalduse protsendi saame nüüd samuti leida:
\(P(lisand)={5.95g\over 7g}*100=85\)%
1.2. Kaltsiumkloriidi kasutatakse lume sulatamiseks sõiduteel. 3.51 tonni loodusliku lubjakivi töötlemisel vesinikkloriidhappega saadi lahus, mis sisaldas 3.00 tonni kaltsiumkloriidi. Mitu protsenti inertseid lisandeid sisaldas lubjakivi? Anna vastus täisarvuna.
Vastus: 23%
Lahendus: Kirjutame välja ja tasakaalustame reaktsioonivõrrandi:
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
Meil on teada, et CaCl2 tekib 3 tonni ehk 3000 kg. Saame leida selle molaarmassi ja arvutada moolide arvu:
M(CaCl2) = 111 g/mol = 111 kg/kmol
\(n={ m\over M}={ 3000kg\over111kg/kmol} = 27.03kmol\)
Reaktsioonivõrrandist näeme, et CaCO3 ja CaCl2 moolsuhe on 1:1, seega on ka CaCO3 moolide arv 27,03 mol. Saame leida selle molaarmassi ja arvutada selle massi:
M(CaCO3) = 100 g/mol = 100 kg/kmol
mCaCO3= n × M = 27,03 kmol × 100 kg/kmol = 2703 kg ≈ 2,70 t
Kui puhast CaCO3 on 3,51 tonnis 2,70 tonni, siis lisandite mass on 3,51–2,70=0,81 tonni. Nüüd saame leida nende sisalduse protsendi lubjakivis:
\(P(lisand)={0.81t\over 3.5t}*100=23\)%
1.3. 5,0 g KClO3, mille puhtus ei olnud teada, kuumutati ja see lagunes kaaliumkloriidiks ja hapnikuks. Reaktsiooni tulemusena tekkis 1,5 g hapnikku.
2KClO3 → 2KCl + 3O2
Kui suur oli lisandite hulk KClO3–s? Anna vastus täisarvuna.
Vastus: 23%
Lahendus: Meil on teada, et O2 tekib 1,5 grammi. Saame leida selle molaarmassi ja arvutada moolide arvu:
M(O2) = 32 g/mol
\(n={ m\over M}={ 1.5g\over32g/mol} = 0.046875mol\)
Reaktsioonivõrrandist näeme, et O2 ja KClO3 moolsuhe on 3:2, seega on KClO3 moolide arv 0,046875 mol×2/3=0,03125 mol. Saame nüüd leida KClO3 molaarmassi ja arvutada selle massi:
M(KClO3) = 122,5 g/mol
m KClO3 = n × M = 0,03125 mol × 122,5 g/mol = 3,83 g
Kui puhast KClO3 on 5 grammis 3,83 g, siis lisandite mass on 5–3,83=1,17 g. Nüüd saame leida nende sisalduse protsendi:
\(P(lisand)={1.17g\over 5g}*100=23.4≈23 \)%
1.4. 5 mooli lämmastiku reageerimisel vesinikuga tekkis 2,5 mol ammoniaaki (NH3). Arvutage, kui suur oli lisandite hulk lähteaines. Anna vastus täisarvuna.
Vastus: 75%
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi: N2 + 3H2 → 2NH3
Kuna reaktsioonivõrrandi järgi on lämmastiku ja tekkiva ammoniaagi moolsuhe 1:2 ja ammoniaagi moolide arv n(NH3) = 2,5 mol on teada, on n(N2) järelikult 2,5/2=1,25 mol. 5 moolis lämmastikus oli lisandeid seega 5–1,25=3,75 mol ja nende protsendiline sisaldus:
\(P(lisand)={3.75mol\over 5mol}*100=75 \)%
Näidisülesanne 2. Lisandite arvestamine saaduse hulga arvutamisel
| 1. Loe ülesande tekst mõttega läbi. |
Raua tootmiseks kasutatakse punast rauamaaki raud(III)oksiidi. Leiti, et rauamaak sisaldab 27% lisandeid. Mitu kg rauda on võimalik saada 500 kg rauamaagist. Raua tootmise täpsem protsess ei ole teada, aga on teada, et rauamaagi ja raua moolsuhe on Fe2O3 → 2Fe |
| 2. Jooni tekstis alla kõik arvud. |
Rauda tootmiseks kasutatakse punast rauamaaki raud(III)oksiidi. Leiti, et rauamaak sisaldab 27% lisandeid. Mitu kg rauda on võimalik saada 500 kg rauamaagist. Raua tootmise täpsem protsess ei ole teada, aga on teada, et rauamaagi ja raua moolsuhe on: Fe2O3 → 2 Fe. |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 27% on lisandite hulk esialgses Fe2O3, rauamaagi kogus koos lisandiga on 500 kg. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
P(lisand) = 27% m(Fe2O3) = 500 kg m(Fe) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. |
Kui lisandite hulk on 27% kogu maagist, siis järelikult on puhast ainet 73%. Puhta rauamaagi mass: $m(puhas\ aine)=\frac{P(puhas\ aine)}{100}\times m(kogu\ aine\ koos\ lisandiga)$ Raua massi leidmiseks peame eelnevalt arvutama, mitu mooli puhast rauamaaki on ülesande järgi antud, ning seejärel võtma arvesse Fe2O3 ja Fe moolsuhet: 1 moolist Fe2O3-st tekib 2 mooli Fe. Fe2O3 moolide arvu leidmine: $n=\frac{m}{M}$ Kui moolide arv on teada, siis saab leida raua massi m = n $\times $ M. |
| 6. Asenda valemitesse arvud ning arvuta. |
$m(Fe_{2}O_{3})=\frac{73}{100}\times\ 500\ kg=365\ kg$ Fe2O3 moolide leidmiseks tuleb eelnevalt arvutada aine molaarmass: M(Fe2O3) = (2 $\times $ 56 + 3 $\times $ 16) g/mol= 160 g/mol $n(Fe_{2}O_{3})=\frac{m}{M}=\frac{365\ 000\ g}{160\ g/mol}=2281\ mol$ Raua moolide leidmiseks arvestame Fe2O3 ja Fe moolsuhet: 1 mooli Fe2O3 vastab 2 mooli Fe: $n(Fe)=2\times 2281\ mol=4562,5\ mol$ Raua massi arvutamiseks kasutame raua molaarmassi: M(Fe) = 56 g/mol m(Fe) = n $\times $ M = 4562,5 mol $\times $ 56 g/mol = 255500 g = 255,5 kg |
Ülesande 2 lahendused
2.1 Söögisooda (NaHCO3) sisaldas 9.0% termiliselt stabiilset naatriumkarbonaati (Na2CO3). Mitu liitrit (nt.) süsinikdioksiidi eraldus 20 g söögisooda lagunemisel. Anna vastus täpsusega üks koht pärast koma.
Vastus: 2,4 l
Lahendus:Kirjutame välja ja tasakaalustame reaktsioonivõrrandi:
2 NaHCO3 → Na2CO3 + CO2 + H2O
Meil on teada, et 20 g söögisoodat sisaldas 9,0% lisandit, seega oli seal puhast NaHCO3 91% ehk 20×0,91=18,2 grammi. Saame leida selle molaarmassi ja arvutada moolide arvu:
M(NaHCO3) = 84 g/mol
\(n={ m\over M}={ 18.2g\over84g/mol} = 0.217mol\)
Reaktsioonivõrrandist näeme, et NaHCO3 ja CO2 moolsuhe on 2:1. Seega tekib süsihappegaasi 0,217/2=0,108 mol. Gaaside puhul kehtib konstant Vm = 22,4 dm3/mol, mille abil saab leida ruumala:
V = n × Vm = 0,108 mol × 22,4 dm3/mol = 2,42 ≈ 2,4 dm3 =2,4 l
2.2 17,5 mooli lämmastiku reageerimisel katalüsaatori juuresolekul piisava hulga vesinikuga tekkis ammoniaak. Arvutuste tulemusena leiti, et lisandite ja kao protsent oli kokku 80 %. Arvuta tekkinud ammoniaagi mass ja ruumala (nt). Anna vastus täisarvuna.
Vastus: 119 g; 157 dm3
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi: N2 + 3H2 → 2NH3
Reaktsioonivõrrandist näeme, et lämmastiku ja ammoniaagi moolsuhe on 1:2. Seega, kui reageeriks 17,5 mooli puhast lämmastikku, tekiks 2×17,5=35 mol. Kuna aga lisandite ja kao protsent on 80%, tekib lämmastikku 20% eeldatavast ehk 0,2×35=7 mol. Seda teades saame arvutada lämmastiku massi ja ruumala:
M(NH3)=17 g/mol
mNH3 = n × M = 7 mol × 17 g/mol = 119 g
V = n × Vm = 7 mol × 22,4 dm3/mol = 156,8 ≈ 157 dm3
2.3 Väävelhappe tootmisel kasutati lähteainena püriiti (FeS2). Püriit sisaldas 16% lisandeid. Mitu kilogrammi vääveldioksiidi saadi 200 kg püriidi särdamisel? Anna vastus täisarvuna.
4FeS2 (t) +11 O2 (g) → 2Fe2O3(t) + 8SO2(g)
Vastus: Püriidi särdamisel saadi 179 kg vääveldioksiidi
Lahendus: Meil on teada, et püriidi mass on 200 kg ja 16% sellest moodustavad lisandid. Puhta FeS2 protsent on seega 84% ja selle mass m(FeS2)=0,84×200=168 kg. Saame leida FeS2 molaarmassi ja moolide arvu:
M(FeS2)=120 g/mol=120 kg/kmol
\(n={ m\over M}={ 168kg\over120kg/kmol} = 1.4kmol\)
Reaktsioonivõrrandist näeme, et FeS2 ja SO2 moolsuhe on 4:8=1:2. Seega tekib vääveldioksiidi 2×1,4=2,8 kmol. Nüüd saab juba molaarmassi kaudu leida vääveldioksiidi massi:
M(SO2)=64 g/mol=64 kg/kmol
mSO2 = n × M = 2,8 kmol × 64 kg/kmol = 179,2 ≈ 179 kg
Näidisülesanne 3. Lähteainete vajaliku koguse arvutamine
| 1. Loe ülesande tekst mõttega läbi. |
10 g kriiti (CaCO3) reageerib vesinikkloriidhappega vastavalt reaktsioonile: CaCO3 + 2HCl → CaCl2 + CO2 + H2O Mitu ml 0,2 M HCl tuleb võtta kogu kriidi ära reageerimiseks, kui kriit sisaldab 8% lisandeid? |
| 2. Jooni tekstis alla kõik arvud. |
10 g kriiti (CaCO3) reageerib vesinikkloriidhappega vastavalt reaktsioonile: CaCO3 + 2HCl → CaCl2 + CO2 + H2O Mitu ml 0,2 M HCl tuleb võtta kogu kriidi ära reageerimiseks, kui kriit sisaldab 8% lisandeid? |
|
3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. |
10 g on kogu kriidi mass, 8% on kriidis sisaldavate lisandite hulk, 0,2 M on vesinikkloriidhappe kontsentratsioon. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
m(kriit) = 10 g P(lisand) = 8% c(HCl) = 0,2 M V(HCl) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. |
Esialgu tuleb arvutada, kui palju on puhast CaCO3 (t), selle saad leida P(CaCO3) = 100 - P(lisand). P(CaCO3) kaudu saab arvutada reaktsioonis osaleva CaCO3 massi. $m(CaCO_{3})=\frac{P(puhas\ aine)}{100}\times m(kogu\ aine\ koos\ lisandiga)$ Seejärel arvutame, mitu mooli CaCO3 on ülesande järgi antud. $n=\frac{m}{M}$ Selleks tuleb enne arvutada CaCO3 molaarmass. Reaktsioonivõrrandi järgi reageerib 1 mol CaCO3 2 moli HCl-ga. HCl ainehulgast saab leida reaktsioonis vajaliku lahuse ruumala: $V=\frac{n}{c}$ |
| 6. Asenda valemitesse arvud ja arvuta. |
P(CaCO3) = (100 - 8)% = 92% $m(CaCO_{3})=\frac{92}{100}\times 10\ g=9,2\ g$ M(CaCO3) = (40 + 12 + 3 × 16) g/mol = 100 g/mol $n(CaCO_{3})=\frac{m}{M}=\frac{9,2\ g}{100\ g/mol}=0,092\ mol$ n(HCl) = 2 × 0,092 mol = 0,184 mol $V(HCl)=\frac{n}{c}=\frac{0,184\ mol}{0,2\ mol/dm^{3}}=0,92\ dm^{3}=920\ cm^{3}(ml)$ |
Ülesande 3 lahendused
3.1 Raua tootmisel magnetiidist kasutati redutseerijana süsinikoksiidi. Mitu kuupmeetrit gaasi kulus 5 tonni maagi redutseerimiseks (nt), mis sisaldas 82% raud(II,III)oksiidi (Fe3O4)? Anna vastus täisarvuna.
Vastus: 1587 dm3
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
Fe3O4 + 4CO → 3Fe + 4CO2
Meil on teada, et magnetiidi mass on 5 tonni ehk 5000 kg, puhta Fe3O4 protsent on selles 82%. Selle mass on seega m(Fe3O4)=0,82×5000=4100 kg. Saame leida Fe3O4 molaarmassi ja moolide arvu:
M(Fe3O4)=231,5 g/mol=231,5 kg/kmol
\(n={ m\over M}={ 4100kg\over231.5kg/kmol} = 17.71kmol\)
Reaktsioonivõrrandist näeme, et Fe3O4 ja CO moolsuhe on 1:4. CO moolide arv on seega 4×17,71=70,84 kmol. Gaasi molaarruumala (22,4 dm3/mol=22,4 m3/kmol) kasutades saame nüüd CO ruumala leida:
V = n × Vm = 70,84 kmol × 22,4 m3/kmol = 1586,86 ≈ 1587 m3
3.2 Tööstuslikku KClO3 sisaldas 23% lisandeid. Soola kuumutati ja see lagunes kaaliumkloriidiks ja hapnikuks.
2KClO3 → 2KCl + 3O2
Reaktsiooni tulemusena tekkis 1,5 g hapnikku. Arvuta mitu grammi tööstuslikku KClO3 võeti 1,5 g hapniku saamiseks? Anna vastus täisarvuna.
Vastus: 5 g
Lahendus: Meil on teada, et O2 tekib 1,5 grammi. Saame leida selle molaarmassi ja arvutada moolide arvu:
M(O2) = 32 g/mol
\(n={ m\over M}={ 1.5g\over32g/mol} = 0.046875mol\)
Reaktsioonivõrrandist näeme, et O2 ja KClO3 moolsuhe on 3:2, seega on KClO3 moolide arv 0,046875 mol×2/3=0,03125 mol. Saame nüüd leida KClO3 molaarmassi ja arvutada selle massi:
M(KClO3) = 122,5 g/mol
mKClO3 = n × M = 0,03125 mol × 122,5 g/mol = 3,83 g
Lisandeid on 23%, seega puhast ainet 77%. Kui sellele vastab 3,83 g, siis tööstusliku aine kogumass on 3,83 × 100% / 77% = 4,974 ≈ 5 g.
3.3 Söögisoola üks peamisi allikaid on merevesi. Merevee soolasus on 3,5%. Arvuta mitu kg merevett peaks võtma, selleks, et saada 5 kg soola. Anna vastus täisarvuna.
Vastus: 143 kg merevett
Lahendus: Kui 3,5% mereveest on 5 kg, siis 100% ehk merevee kogumass vastab 5 kg × 100% / 35% = 142,85 ≈ 143 kg.
3.4 Mitu kilogrammi etanooli (C2H5OH) saab toota 25g glükoosist (C6H12O6), mis sisaldab 28% lisandeid?
C6H12O6 → 2 C2H5OH + CO2
Anna vastus täpsusega üks koht peale koma.
Vastus: 9,2 g
Lahendus: Meil on teada, et koos lisanditega glükoosi mass on 25 g, lisandeid on selles 28%. Puhta glükoosi protsent on seega 72% ja selle mass on m(glükoos) = 0,72 × 25 = 18 g. Saame leida glükoosi molaarmassi ja selle kaudu moolide arvu:
M(glükoos)=180 g/mol
\(n={ m\over M}={ 18g\over180g/mol} = 0.1mol\)
Reaktsioonivõrrandist näeme, et glükoosi ja etanooli moolsuhe on 1:2, seega on etanooli moolide arv 2×0,1=0,2 mol. Saame nüüd leida etanooli molaarmassi ja arvutada selle massi:
M(C2H5OH) = 46 g/mol
mC2H5OH = n × M = 0,2 mol × 46 g/mol = 9,2 g
2.8. Arvutused saagise ja kao põhjal
Võib juhtuda, et tegelike saaduste hulk erineb oluliselt teoreetiliselt arvutatud kogustest. Reaktsiooni saagis näitab, mitu protsenti moodustab tegelikult saadud reaktsioonisaaduse hulk (või mass) reaktsioonivõrrandi järgi teoreetiliselt arvutatud reaktsioonisaaduse hulgast (või massist). Järgnevas videos saad vaadata, kuidas arvutada reaktsiooni saagist.
Allikas: https://youtu.be/0epwo6KCfbQ
Aine massi või hulka, mis protsessi tulemusel saadakse, mõjutavad paljud tegurid, näiteks gaasiliste ainete korral võib osa ainet lenduda.
Reaktsiooni saagise arvutamisel kasutatakse protsendi arvutamise reegleid. Saagise, tavaliselt saagise protsendi leidmiseks saab kasutada järgmist valemit:
$P(saagis)=\frac{m(protsessi\ käigus\ saadud\ aine\ mass)}{m(arvutatud\ mass)})\times 100$
Sarnaselt massidega saab saagist arvutada ka ainehulga kaudu:
$P(saagis)=\frac{n(protsessi\ käigus\ saadud\ a\mspace{0mu}inehulk)}{n(arvutatud\ a\mspace{0mu}inehulk)}\times 100$
Näidisülesanne 1. Reaktsiooni saagise arvutamine
| 1. Loe ülesande tekst mõttega läbi. |
Arvuta saagise protsent, kui 6,5 grammi fruktoosi lagunemisel allpool toodud reaktsiooni alusel tekkis 1,27 dm3 süsihappegaasi (nt). C6H12O6 → 2C2H5OH + 2CO2 |
| 2. Jooni tekstis alla kõik arvud. |
Arvuta saagise protsent, kui 6,5 grammi fruktoosi lagunemisel allpool toodud reaktsiooni alusel tekkis 1,27 dm3 süsihappegaasi (nt). C6H12O6 → 2C2H5OH + 2CO2 |
|
3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. |
6,5 g fruktoosi on lähteaine kogus. 1,27 dm3 on süsihappegaasi ruumala, mis protsessi käigus lõpuks saadi. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
m(C6H12O6) = 6,5 g V(CO2) = 1,27 dm3 P(saagis) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. |
Süsihappegaasi saab leida valemiga $n=\frac{V}{V_{m}}$ C6H12O6 massi saab leida m(C6H12O6) = n $\times $ M. Saagise protsendi leidmiseks saab kasutada järgmist valemit: $P(saagis)=\frac{m(reaalse\ protsessi\ käigus\ saadud\ aine\ mass)}{m(teoreetiliselt\ saadud\ aine\ mass)})\times 100$ |
|
6. Asenda valemitesse arvud ning teosta arvutused. |
Praktiliselt tekkinud süsihappegaasi hulk: $n(CO_{2})=\frac{V}{V_{m}}=\frac{1,27\ dm^{3}}{22,4\ dm^{3}/mol}=0,057\ mol$ Süsihappegaasi teoreetilise hulga arvutamiseks arvutame fruktoosi molaarmassi ja selle kaudu fruktoosi hulga moolides: M(C6H12O6) = 6 $\times $ 12 + 12 $\times $ 1 + 6 $\times $ 16 = 180 g/mol $n(C_{6}H_{12}O_{6})=\frac{m}{M}=\frac{6,5\ g}{180\ g/mol}=0,036\ mol$ Reaktsioonivõrrandi alusel tekib 1 mooli C6H12O6 kohta 2 mooli CO2. Järelikult peaks süsihappegaasi teoreetiliselt tekkima n(CO2) = 2 $\times $ 0,036 mol = 0,072 mol Reaktsiooni saagis: $P(saagis)=\frac{0,057\ mol}{0,072\ mol}\times 100=79,2\%\approx 79\%$ |
Ülesande 1 lahendused
1.1. 5 g KClO3 kuumutati ja see lagunes kaaliumkloriidiks ja hapnikuks. Mis on saagise protsent, kui reaktisooni tulemusena tekkis 1,5 g hapnikku. Anna vastus täisarvuna.
2KClO3 → 2KCl + 3O2
Vastus: Saagise protsent on 77%
Lahendus: Esmalt arvutame, kui palju hapnikku oleks teoreetiliselt pidanud tekkima. Meil on teada KClO3 mass m=5 g, seega saame arvutada selle moolide arvu:
M(KClO3) = 122,5 g/mol
\(n = {m \over M}={5g \over 122.5g/mol}=0.0408mol\)
Reaktsioonivõrrandi järgi on KClO3 ja hapniku moolsuhe 2:3, seega oleks hapnikku pidanud tekkima 0,0408 × 3 / 2 = 0,061 mooli. Leiame nüüd tekkinud hapniku massi kaudu, kui palju seda tegelikult tekkis:
M(O2) = 32 g/mol
\(n = {m \over M}={1.5g \over 32g/mol}=0.047mol\)
Kuna nüüd on teada nii eeldatav hapniku ainehulk kui ka tegelik hapniku ainehulk, saame arvutada saagise:
\(P(Saagis) = {0.047mol \over 0.061mol}*100=77\)%
1.2. 5 mooli lämmastiku reageerimisel vesinikuga tekkis 2,5 mol ammoniaaki (NH3). Arvutage reaktasiooni saagise protsent. Anna vastus täisarvuna.
Vastus: 25%
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi: N2 + 3H2 → 2NH3
Reaktsioonivõrrandist näeme, et lämmastiku ja ammoniaagi moolsuhe on 1:2. Seega oleks 5 mooli lämmastiku reageerimisel pidanud teoreetiliselt tekkima 2×5=10 mol ammoniaaki. Tekkis aga 2,5 mol, seega on reaktsiooni saagis:
\(P(Saagis) = {2.5mol \over 10mol}*100=25\)%
1.3. 17,5 mooli lämmastiku reageerimisel katalüsaatori juuresolekul piisava hulga vesinikuga tekkis 115 g ammoniaaki. Arvutage reaktsiooni saagise % ja eraldunud ammoniaagi ruumala (nt.). Anna vastus täisarvuna.
Vastus: 19%, 152 dm3
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi: N2 + 3H2 → 2NH3
Reaktsioonivõrrandist näeme, et lämmastiku ja ammoniaagi moolsuhe on 1:2. Seega oleks 17,5 mooli lämmastiku reageerimisel pidanud teoreetiliselt tekkima 2×17,5=35 mol ammoniaaki. Leiame aga antud ammoniaagi massi kaudu, kui palju seda päriselt tekkis:
M(NH3)=17 g/mol
\(n = {m \over M}={115g \over 17g/mol}=6.77mol\)
Reaktsiooni saagis on seega:
\(P(Saagis) = {6.77mol \over 35mol}*100=19\)%
Ja eraldunud ammoniaagi ruumala:
V = n × Vm = 6,77 mol × 22,4 dm3/mol = 151,5 ≈ 152 dm3
1.4. 340 g ammoniaagi (NH3) sünteesiks kulus 896 dm3 vesinikku. Leida sünteesi saagise protsent. Anna vastus täisarvuna.
Vastus: 75%
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi: N2 + 3H2 → 2NH3
Esmalt arvutame, kui palju ammoniaaki oleks teoreetiliselt pidanud tekkima. Meil on teada vesiniku ruumala V=896 dm3, seega saame arvutada selle moolide arvu:
\(n = {V \over V_m}={896dm^3 \over 22.4dm^3/mol}=40mol\)
Reaktsioonivõrrandist näeme, et vesiniku ja ammoniaagi moolsuhe on 3:2. Seega oleks 40 mooli lämmastiku reageerimisel pidanud teoreetiliselt tekkima 40 × 2 / 3 = 26,67 mooli ammoniaaki. Leiame aga antud ammoniaagi massi kaudu, kui palju seda päriselt tekkis:
M(NH3)=17 g/mol
\(n = {m \over M}={340g \over 17g/mol}=20mol\)
Reaktsiooni saagis on seega:
\(P(Saagis) = {20mol \over 26.67mol}*100=75\)%
1.5. Väävelhappe tootmisel kasutati lähteainena püriiti (FeS2). 200 kg püriidi särdamisel saadi 180 kg vääveldioksiidi. Kui suur on protsessi saagis? Anna vastus täisarvuna.
Vastus: 84%
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
4FeS2 +11 O2 → 2Fe2O3 + 8SO2
Esmalt arvutame, kui palju vääveldioksiidi oleks teoreetiliselt pidanud tekkima. Meil on teada FeS2 mass m=200 kg, seega saame arvutada selle moolide arvu:
M(FeS2) = 120 g/mol=120 kg/kmol
\(n = {m \over M}={200kg \over 120kg/kmol}=1.67kmol\)
Reaktsioonivõrrandist näeme, et FeS2 ja SO2 moolsuhe on 4:8=1:2. Seega oleks 1,67 kilomooli FeS2 reageerimisel pidanud teoreetiliselt tekkima 2×1,67=3,34 kmol vääveldioksiidi. Leiame aga antud vääveldioksiidi massi kaudu, kui palju seda päriselt tekkis:
M(SO2)=64 g/mol=64 kg/kmol
\(n = {m \over M}={180kg \over 64kg/kmol}=2.81kmol\)
Reaktsiooni saagis on seega:
\(P(Saagis) = {2.81kmol \over 3.34kmol}*100=84\)%
Näidisülesanne 2. Saaduse koguse arvutamine, arvestades reaktsiooni kadu
| 1. Loe ülesande tekst mõttega läbi. |
Püriidi (FeS2) põletamisel (särdamisel) saadakse gaasiline SO3. Reaktsiooni kohta võib välja kirjutada järmise suhte: |
| 2. Jooni tekstis alla kõik arvud. |
Püriidi (FeS2) põletamisel (särdamisel) saadakse gaasiline SO3. Reaktsiooni kohta võib välja kirjutada järmise suhte: |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. | 250 g on püriidi mass, 12% on kadu, mis tähendab, et protsessi käigus saadava aine kogus on teoreetilisest väiksem: 100% - 12%= 88%. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
m(püriiit) = 250 g P(kadu) = 12% m(SO3) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. |
Arvuta mitu mooli esialgset ainet hakkas reageerima. $n(püriit)=\frac{m}{M}$ Seejärel võta saaduste tekke puhul arvesse reaktsioonivõrrandist tulenevat moolsuhet. 1 mooli püriidi lagunemisel tekib 2 mooli SO3, seega tekkinud SO3 ainehulk on kaks korda suurem püriidi omast. SO3 massi saad leida valemist m(SO3) = n $\times $ M. Kuna protsessi käigus on kadu 12% siis tekkinud aine mass on 88% arvutatud SO3 massist. |
| 6. Asenda valemitesse arvud ning teosta arvutused. |
M(FeS2) = 56 + 2 $\times $ 32= 120 g/mol $n(püriit)=\frac{m}{M}=\frac{250\ g}{120\ g/mol}=2,08\ mol$ n(SO3) = 2 $\times $ 2,08 = 4,16 mol M(SO3) = 32 + 3 $\times $ 16= 80 g/mol
SO3 teoreetiline mass: Tegelik mass on teoreetilisest väiksem: m(SO3) = 0,88 $\times $ 332,8 g = 293 g |
Ülesande 2 lahendused
2.1 0.08 mooli gaasilist vesinikkloriidi juhiti naatriumsulfiidi lahusesse. Arvutage, mitu mooli ja mitu dm3 gaasilist divesiniksulfiidi eraldus normaaltingimustel (Vm = 22.4 dm3/mol), kui reaktsiooni saagis on 75%. Anna vastus täpsusega kaks kohta pärast koma.
Vastus: 0,03 mol; 0,67 dm3
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
Na2S + 2HCl → 2NaCl + H2S
Reaktsioonivõrrandist näeme, et HCl ja H2S moolsuhe on 2:1. Seega peaks H2S teoreetiliselt tekkima 0,08/2=0,04 mol. Kuna aga saagis oli 75%, tekkis tegelikult 0,04×0,75=0,03 mol divesiniksulfiidi. Leiame selle vastava ruumala:
V = n × Vm = 0,03 mol × 22,4 dm3/mol = 0,672 ≈ 0,67 dm3
2.2. 3,1 tonni puidu tselluloosi hüdrolüüsil tekkis 0.81 tonni glükoosi. Saadud glükoos kääritati täielikult etanooliks:
C6H12O6→2C2H5OH + 2CO2.
Etanooli dehüdraatimise saada eteen. Mitu m3 eteeni võib saada normaaltingimustel etanoolist, kui kadu protsessil on 40%? Anna vastus täisarvuna.
C2H5OH → C2H4 + H2O
Vastus: 121 m3
Lahendus: Ülesande lahendamiseks tuleb esmalt leida etanooli kogus, millest eteeni valmistati. Selleks lähtume glükoosi kääritamise reaktsioonist, mis kulges täielikult. Kuna on teada, et glükoosi mass on m=0,81 t=810 kg, leiame glükoosi moolide arvu:
M(glükoos)=180 g/mol=180 kg/kmol
\(n = {m \over M}={810kg \over 180kg/kmol}=4.5kmol\)
Glükoosi ja etanooli moolsuhte 2:1 järgi leiame, et etanooli tekkis 2×4,5=9 kmol. Etanooli dehüdraatimise reaktsioonivõrrandist näeme, et etanooli ja eteeni moolsuhe on 1:1, seega eteeni teoreetiline saagis on 9 kmol. Teame, et kadu on 40%, seega on reaktsiooni saagis 60% ja eteeni tekib tegelikult 0,6×9=5,4 kmol. Leiame selle ruumala:
V = n × Vm = 5,4 kmol × 22,4 m3/kmol =1 20,96 ≈ 121 m3
2.3. Mitu kilogrammi etanooli (C2H5OH) saab mahla kääritamisel toota, kui mahl sisaldab 25 kg glükoosi (C6H12O6) ja kääritamise saagis on 72%? Anna vastus täpsusega üks koht peale koma.
Vastus: 9,2 kg etanooli
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
C6H12O6→2C2H5OH + 2CO2
Leiame kõigepealt glükoosi moolide arvu:
M(glükoos)=180 g/mol=180 kg/kmol
\(n = {m \over M}={25kg \over 180kg/kmol}=0.14kmol\)
Reaktsioonivõrrandist näeme, et glükoosi ja etanooli moolsuhe on 1:2. Seega tekib etanooli teoreetiliselt 2×0,14=0,28 kmol. Kuna saagis on 72%, tekib seda tegelikult 0,72×0,28=0,20 kmol. Leiame selle abil nüüd etanooli massi:
M(C2H5OH) = 46 g/mol=46 kg/kmol
mC2H5OH = n × M = 0,2 kmol × 46 kg/kmol = 9,2 kg
2.4. Sama ülesanne mis Näidisülesandes 1.5.
Näidisülesanne 3. Lähteainete vajaliku koguse arvutamine, arvestades reaktsiooni saagist
| 1. Loe ülesande tekst mõttega läbi. |
KCl tööstusliku sünteesiprotsessi kohta on teada, et saagis on 70%. Mitu grammi lähteainet on vaja võtta selleks, et tekiks 500 g KCl? Reaktsioonivõrrand on 2KClO3 → 2KCl + 3O2 |
| 2. Jooni tekstis alla kõik arvud. |
KCl tööstusliku sünteesiprotsessi kohta on teada, et saagis on 70%. Mitu grammi lähteainet on vaja võtta selleks, et tekiks 500 g KCl? Reaktsioonivõrrand on 2KClO3 → 2KCl + 3O2 |
| 3. Omista arvule kindel füüsikaline suurus. Seda on lihtne teha näiteks ühiku alusel. |
Protsessi saagis on 70%, tekkinud KCl mass on 500 g. |
| 4. Kirjuta välja andmed ning otsitav suurus. |
P(saagis) = 70% m(KCl) = 500 g m(KClO3) = ? |
| 5. Kirjuta välja valemid ning kui vaja, avalda valemist otsitav suurus. |
Esmalt arvutame lähteaine moolide arvu $n=\frac{m}{M}$ Lähteaine ja saaduse moolide suhe on reaktsioonivõrrandis sama, järelikult n(KCl ) = n(KClO3) Seejärel saab arvutada KClO3 massi m(KClO3) = n $\times $ M Kuna saagis on 70%, siis tuleb võtta lähteainet rohkem. |
| 6. Asenda valemitesse arvud ja arvuta. |
Leiame saaduse hulga moolides: M(KCl) = 39 + 35,5 = 74,5 g/mol $n(KCl)=\frac{m}{M}=\frac{500\ g}{74,5\ g/mol}=6,7\ mol$ Järelikult ka n(KClO3) = 6,7 mol Arvutame KClO3 massi: M(KClO3) = 39 + 35,5 + 3 $\times $ 16 = 122,5 g/mol m(KClO3) = n $\times $ M =6,7 mol $\times $ 122,5 g/mol = 820,75 g $m(aine\ koos\ kaoga)=\frac{100}{70}\times 820,75\ g=1172,5\ g$ Kõige olulisem on sellist tüüpi ülesannete puhul mõista, et kuna reaktsiooni käigus tekib kadu ehk saagis on alla 100%, siis selleks, et saada oodatavat hulka saadust, on vaja esialgset lähteainet või lähteaineid võtta rohkem. Sama kehtib ka lisandite korral. |
Ülesande 3 lahendused
3.1 Glükoos kääritati täielikult etanooliks:
C6H12O6→2C2H5OH + 2CO2.
Saadud etanoolist saadi dehüdraatimise teel 150 dm3 (nt) eteeni, protsessi kadu oli 45 %.
C2H5OH → C2H4 + H2O
Mitu kg glükoosi pidi protsessi jaoks võtma? Anna vastus täisarvuna.
Vastus: 1 kg
Lahendus: Glükoosi massi leidmiseks on vaja teada etanooli ainehulka. Saame selle eteeni ruumala ja eteeni saamise reaktsiooni saagise abil arvutada. Esmalt tuleb leida eteeni moolide arv:
\(n = {V \over V_m}={150dm^3 \over 22.4dm^3/mol}=6.7mol\)
Kuna protsessi kadu oli 45%, vastab 6,7 mol järelikult 55%-le. Teoreetiliselt oleks seega pidanud tekkima 6,7/0,55=12,2 mol.
Etanooli dehüdraatimise reaktsiooni järgi on etanooli ja eteeni moolsuhe 1:1, seega oli reageerivat etanooli 12,2 mol. Glükoosi kääritamise reaktsiooni järgi on glükoosi ja etanooli moolsuhe 1:2, millest saab tuletada, et glükoosi oli 12,2/2=6,1 mol. Nüüd saame juba leida glükoosi massi:
M(glükoos)=180 g/mol
mglükoos = n × M = 6,1 mol × 180 g/mol = 1098 g = 1,098 ≈ 1 kg
3.2. Mahla kääritamise tulemusena saadi 50 kg etanooli (C2H5OH). Mitu grammi glükoosi (C6H12O6) pidi mahl sisaldama, kui kääritamise protsessi saagis oli 72%?
C6H12O6→2C2H5OH + 2CO2. Anna vastus täisarvuna.
Vastus: Glükoosi läheb tarvis 136 kg.
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
C6H12O6→2C2H5OH + 2CO2
Esmalt saame leida etanooli moolide arvu:
M(C2H5OH) = 46 g/mol=46 kg/kmol
\(n = {m \over M}={50kg \over 46kg/kmol}=1.09kmol\)
Kuna aga protsessi saagis oli 72%, pidanuks etanooli teoreetiliselt tekkima 1,09/0,72=1,51 kmol.
Reaktsioonivõrrandi järgi näeme, et glükoosi ja etanooli moolsuhe on 1:2, seega oli glükoosi moolide arv 1,51/2=0,755 kmol. Nüüd saame leida glükoosi massi:
M(glükoos)=180 g/mol=180 kg/kmol
mglükoos = n × M = 0,755 kmol × 180 kg/kmol = 135,9 ≈ 136 kg
3.3. Väävelhappe tootmisel kasutati lähteainena püriiti (FeS2). Püriidi särdamisel (põletamisel) saadi 180 kg vääveldioksiidi. Kui palju püriiti pidi säristamiseks võtma, kui protsessi saagise protsent on 84%? Anna vastus täisarvuna.
Vastus: 201 kg
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi:
4FeS2 +11 O2 → 2Fe2O3 + 8SO2
Arvutame esmalt vääveldioksiidi moolide arvu:
M(SO2)=64 g/mol=64 kg/kmol
\(n = {m \over M}={180kg \over 64kg/kmol}=2.81kmol\)
Kuna aga protsessi saagis oli 84%, pidanuks vääveldioksiidi teoreetiliselt tekkima 2,81/0,84=3,345 kmol.
Reaktsioonivõrrandist näeme, et FeS2 ja SO2 moolsuhe on 4:8=1:2. Seega oli FeS2 moolide arv 3,345/2=1,673 kmol. Leiame selle massi:
M(FeS2) = 120 g/mol=120 kg/kmol
m = n × M = 1,673 kmol × 120 kg/kmol = 200,76 ≈ 201 kg
3.4. Vesiniku ja lämmastiku vahelisel reaktsioonil kõrgel temperatuuril saadi 115 g ammoniaaki saagisega 25%. Arvuta mitu liitrit vesinikku võeti reaktsiooniks?
Vastus: Vesinikku võeti 909 liitrit.
Lahendus: Kirjutame ja tasakaalustame reaktsioonivõrrandi: N2 + 3H2 → 2NH3
Esmalt leiame olemasolevate andmete abil ammoniaagi moolide arvu:
M(NH3)=17 g/mol
\(n = {m \over M}={115g \over 17g/mol}=6.765mol\)
Kuna aga protsessi saagis oli 25%, pidanuks ammoniaaki teoreetiliselt tekkima 6,765/0,25=27,06 mol.
Reaktsioonivõrrandist näeme, et ammoniaagi ja vesiniku moolsuhe on 2:3, seega vesiniku moolide arv oli 27,06 × 3 / 2= 40,6 mol. Nüüd saame leida vesiniku ruumala:
V = n × Vm = 40,6 mol × 22,4 dm3/mol = 909,22 ≈ 909 dm3