7.1. Alkoholid
Alkoholi üldvalem: R–OH
Alkoholid on orgaanilised ained, milles sisaldub –OH ehk hüdroksüülrühm. Hüdroksüülrühma võib ette kujutada kui vee molekulist vesiniku eemaldamisel saadavat rühma. Igapäevaelus kasutatakse alkoholidest kõige enam etanooli (CH3CH2OH) – lahusti, kütusena ning ka alkohoolsete jookide saamiseks. Alkoholidega saad lähemalt tutvuda järgmises videos.
Allikas: https://youtu.be/gf3P84DcUVM
Alkoholide nimetamine
Alkoholide nimetamisel kasutakse järelliidet -ool. Näiteks CH3OH on metanool, CH3CH2OH etanool, CH3CH2CH2OH propanool jne. Pikema süsinikuahela puhul tuleb alkoholi korrektseks nimetamiseks arvestada ka seda, millise süsinikuaatomiga on hüdroksüülrühm seotud.
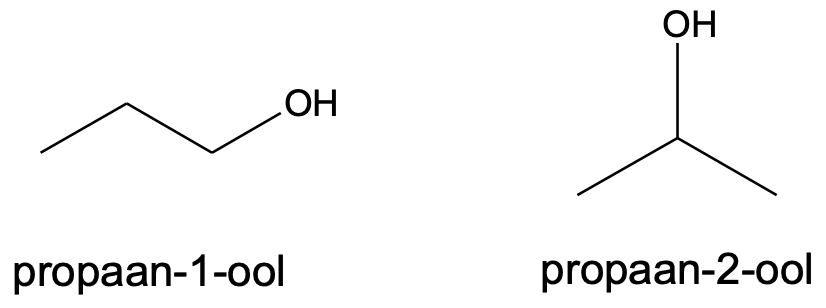
Kui hüdroksüülrühmi on rohkem kui üks, tuleb lisada nende arvu näitav eesliide.
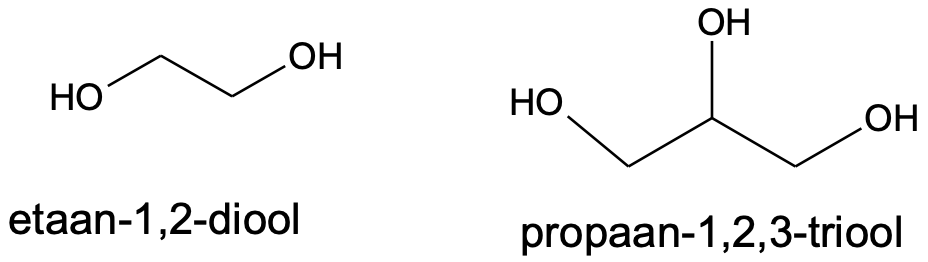
Mõnede alkoholide korral kasutatakse sageli ka mittesüstemaatilisi nimetusi, näiteks tuntakse propaan-1,2,3-triooli glütseroolina.
Alkoholide füüsikalised omadused
Alkoholid on polaarsed ja hüdrofiilsed ained, sest alkoholide molekulide vahel on vesiniksidemed.
Alkoholid on polaarsed ja hüdrofiilsed ained, sest alkoholide molekulide vahel on vesiniksidemed. Vesiniksidemed on tugevamad kui tüüpilised molekulidevahelised jõud, seetõttu on alkoholide keemistemperatuurid kõrgemad kui enamikul sarnase molekulmassiga orgaanilistel ühenditel, mille molekulide vahel vesiniksidemeid ei esine (nt süsivesinikud).
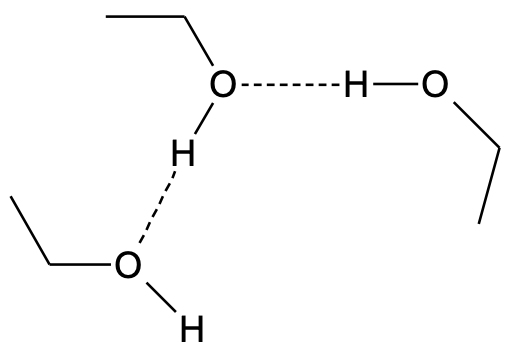
Joonis 1. Vesiniksidemed (märgitud punktiirjoonega) etanooli molekulide vahel
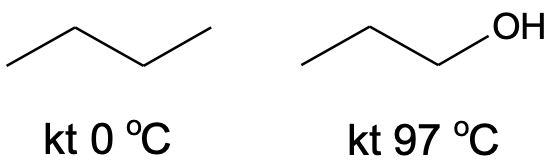
Joonis 2. Propaan-1-ooli keemistemperatuur on ligi 100 °C kõrgem kui butaani oma, ehkki nende molekulid on sarnase suurusega.
Kuna alkoholid moodustavad vesiniksidemeid ka veemolekulidega, lahustuvad lühema süsikahelaga alkoholid vees hästi. Esimesed kolm lineaarse ahelaga alkoholi segunevad veega igas vahekorras, süsinikahela pikenemisel väheneb aga ka alkoholide lahustuvus vees, sest alküülrühm on hüdrofoobne.
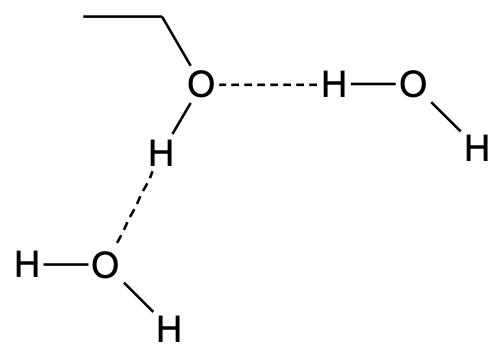
Joonis 3. Vesiniksidemed etanooli ja vee molekulide vahel
Tabel 1. Lihtsamate alkoholide keemistemperatuur ja lahustuvus vees
|
Alkohol |
CH3OH |
CH3CH2OH |
CH3(CH2)2OH |
CH3(CH2)3OH |
CH3(CH2)4OH |
|
Keemis-temperatuur, °C |
65 |
78 |
97 |
117 |
138 |
|
Lahustuvus vees, g/l |
seguneb igas vahekorras |
seguneb igas vahekorras |
seguneb igas vahekorras |
73 |
22 |
 Loe lisaks: Kuidas moodustub vesinikside?
Loe lisaks: Kuidas moodustub vesinikside?
O–H ja N–H sidemed on tugevalt polaarsed. Sidemeelektronide paari tõmmatakse tugevamini O või N aatomi juurde ning H aatomi juurde jääb elektronide puudujääk. Seetõttu on O või N aatomi juures negatiivne osalaeng (täisarvulisest laengust väiksem laeng), H aatomi juures positiivne osalaeng.

Vesiniku positiivne osalaeng tõmbab enda juurde negatiivse osalaenguga O või N aatomi elektronipaari, mille käigus moodustubki vesinikside.
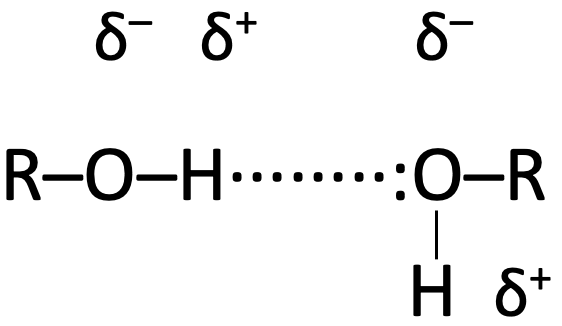
Vesinikside on tugevam kui tüüpilised molekulidevahelised jõud, kuid palju nõrgem kui kovalentne side (tüüpiline vesinikside on umbes 10 korda nõrgem kui kovalentne side).
Vesiniksidemeid moodustab ka H–F.
Alkoholide keemilised omadused
Põlemine on alkoholide täielik oksüdeerumine.
CH3CH2OH + 3 O2→ 2 CO2 + 3 H2O
Alkoholid (metanool, etanool) põlevad kergesti ja neid saab kasutada ka kütusena, kuigi need annavad massiühiku kohta vähem energiat kui süsivesinikud. Alkoholide osalist oksüdeerumist vaatleme hiljem.
Kuigi hüdroksüülrühm võib esmapilgul meenutada hüdroksiidiooni, on alkoholide vesilahused neutraalsed. Hüdroksüülrühm võib teatud reaktsioonides, nt reageerides leelismetallidega, käituda isegi happena (nii nõrk hape, mida indikaatorid ei suuda tuvastada). Alkoholide happelised ja aluselised omadused on sarnased veele.
Alkoholide biotoime
Paljud alkoholid on mürgised. Eriti ohtlik on metanool, mille joomine võib ka väikeses koguses põhjustada pimedaks jäämist või surma. Ka etanool – alkohoolsete jookide joovastav toimeaine – on mõnevõrra mürgine. Suhteliselt mõõdukas koguses on etanool lõõgastava ja eufooriat tekitava toimega, suuremas koguses peamiselt depressant – kesknärvisüsteemi tööd aeglustav aine. Suured etanoolikogused põhjustavad uimasust, iiveldust, koordinatsiooni- ja kõneprobleeme ning mäluhäireid, väga suured kogused võivad põhjustada isegi teadvusekaotust või surma. Etanooli tarvitamine suurendab ka ohtlikesse õnnetustesse sattumise riski. Etanooli sage tarvitamine pikema ajaperioodi vältel tõstab vähki haigestumise riski, võib põhjustada sõltuvust (alkoholismi) ning kahjustada maksa ja närvisüsteemi.

