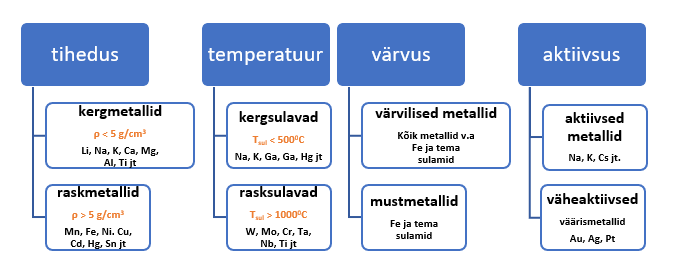
4.4. Metallide füüsikalised omadused
Paljud metallide füüsikalised omadused on meile tuttavad argielu kogemustest. Kindlasti tead, et enamik metalle peegeldab hästi valgust. Peegeldus ja läige avalduvad eriti hästi poleeritud pinnal. Parima peegeldusvõimega on Ag, Al ja In, mistõttu neid kasutatakse peeglite valmistamisel. Metallide üldiste omaduste kohta saad vaadata järgnevast videost.
Allikas: https://youtu.be/Bei8q6d46RE
Metallid on head soojusjuhid.
Metallid on head soojusjuhid. Metalleseme kuumutamisel levib soojus kiiresti üle kogu eseme. Mainimata ei saa jätta metallide head elektrijuhtivust, mis võimaldab neid kasutada elektrijuhtmete valmistamsel ning erinevates kontaktides. Ag, Cu, Al, Au, Fe juhivad elektrit hästi, Pb ja Hg halvasti.
Metallide erijuhtivus
Erinevate metallide juhtivate omaduste võrdlemisel kasutatakse suurust erijuhtivus. Erijuhtivus iseloomustab aine või materjali võimet elektrit juhtida. Mida suurem on arvuliselt erijuhtivus, seda paremini materjal juhib elektrit.
Mõningate metallide erijuhtivusi näeb tabelist 1. Kõige parem elektrijuht on Ag, teisel kohal on vask. Head erijuhtivuse omadused on tingitud vabadest elektronidest aatomi välisel elektronkihil (joonis 1).
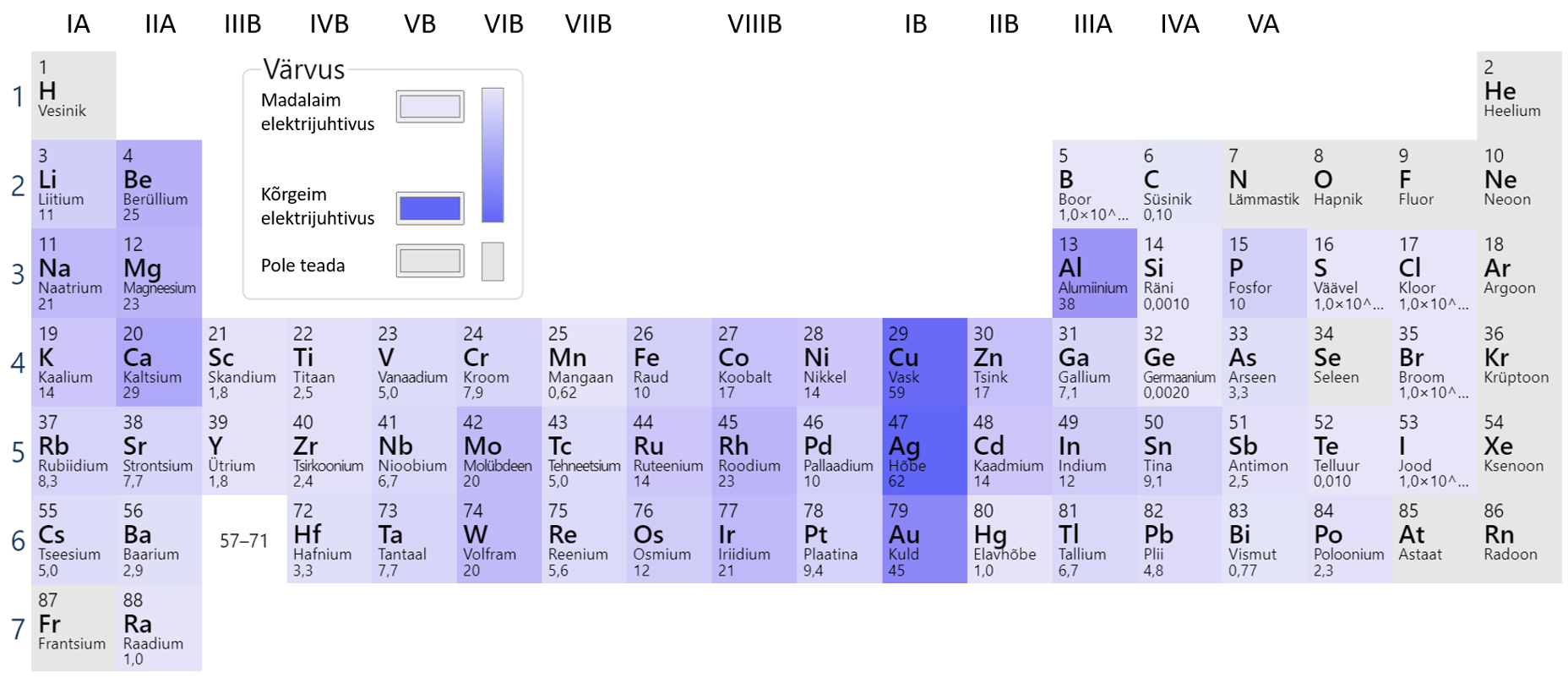
Joonis 1. Metallide elektrijuhtivuse võrdlus. Allikas: https://ptable.com/?lang=et#Properties/Conductivity/Electric
Ka leelismetallid on head elektrijuhid, kuna nende aatomite välisel elektronkihil on üks vaba elektron. Väga suure keemilise aktiivsuse tõttu pole aga leelismetallid praktiliseks kasutamiseks sobilikud.
Tabel 1. Metallide füüsikalised omadused
|
Al |
Fe |
Cu |
Ag |
Au |
Sn (α-Sn) |
W |
|
|
Sulamistemperatuur (oC) |
660 |
1535 |
1083 |
962 |
1064 |
232 |
3380 |
|
Tihedus (g/cm3) |
2,70 |
7,87 |
8,960 |
10,5 |
19,32 |
5,77 |
19,30 |
|
Erijuhtivus (S/m) |
35,7 |
10,2 |
58.1 |
62,5 |
41,7 |
8,3 |
18,2 |
Metallide värvus
Kuigi metallidel on palju ühiseid omadusi, võivad nende füüsikalised omadused üsna tugevalt erineda. On metalle, mis mõne oma omaduse poolest teistest oluliselt erinevad. Tüüpilisi metallide värvusi näeb jooniselt 2. Enamik metalle on tüki või lehe kujul hõbevalged või halli värvi, aga kuld on kollane ja vask punakas. Pulbrina on metallid tuhmhallid või hoopiski mustad (joonist 3), kuna metalli pind oksüdeerub kiiresti õhuhapnikuga ja metalli pinnale tekib oksiidide kiht. Alumiiniumil ja magneesiumil säilib hõbedane läige ka pulbri kujul. Metallid erinevad üksteisest ka iseloomuliku helgi poolest. Näiteks Cr ja Pb helgivad sinakalt, Bi punakalt, Ni kollakalt, Zn sinakasvalgelt.

Joonis 2. Metallide värvused

Joonis 3. Pulbrilise ja tükilise metalli omaduste võrdlus
Kui enamik metalle on tavatingimustel tahked ained, siis termomeetrites kasutatav elavhõbe on erand – toatemperatuuril on Hg vedelik (vaata joonist 4).
Joonis 4. Elavhõbe (Hg)
Metallide kõvadus
Metallidel on väga erinev kõvadus. Leelismetallid ning osad leelismuldmetallid on noaga hästi lõigatavad. Rühmas allpool olevaid metalle on noaga lihtsam lõigata. Liitiumi on mõnevõrra raskem lõigata kui kaaliumi (vaata joonist 5).

Joonis 5. Lõikamisel tekkiv läikiv liitiumi pind oksüdeerub kiiresti õhuhapnikuga ning sama juhtub kaaliumiga. Liitiumi pinna tuhmumine on seotud Li2O tekkega pinnale, kaaliumi korral tekib pinnale peroksiidide kiht, KO2. Liitiumit on skalpelliga raskem lõigata kui kaaliumi.
Teiste metallide lõikamiseks tuleb kasutada spetsiaalseid vahendeid. Suhteliselt pehmed metallid on ka puhas kuld, plii ja tina, mida saab küünega kriimustada. Kõige kõvem metall on kroom, terava kroomitükiga on võimalik kriimustada klaasi. Metallide kõvadus sõltub puhtusest. Puhtad metallid on pehmemad, lisandid suurendavad metalli kõvadust. Erinevate metallide kõvaduse võrdlust näed joonisel 6.
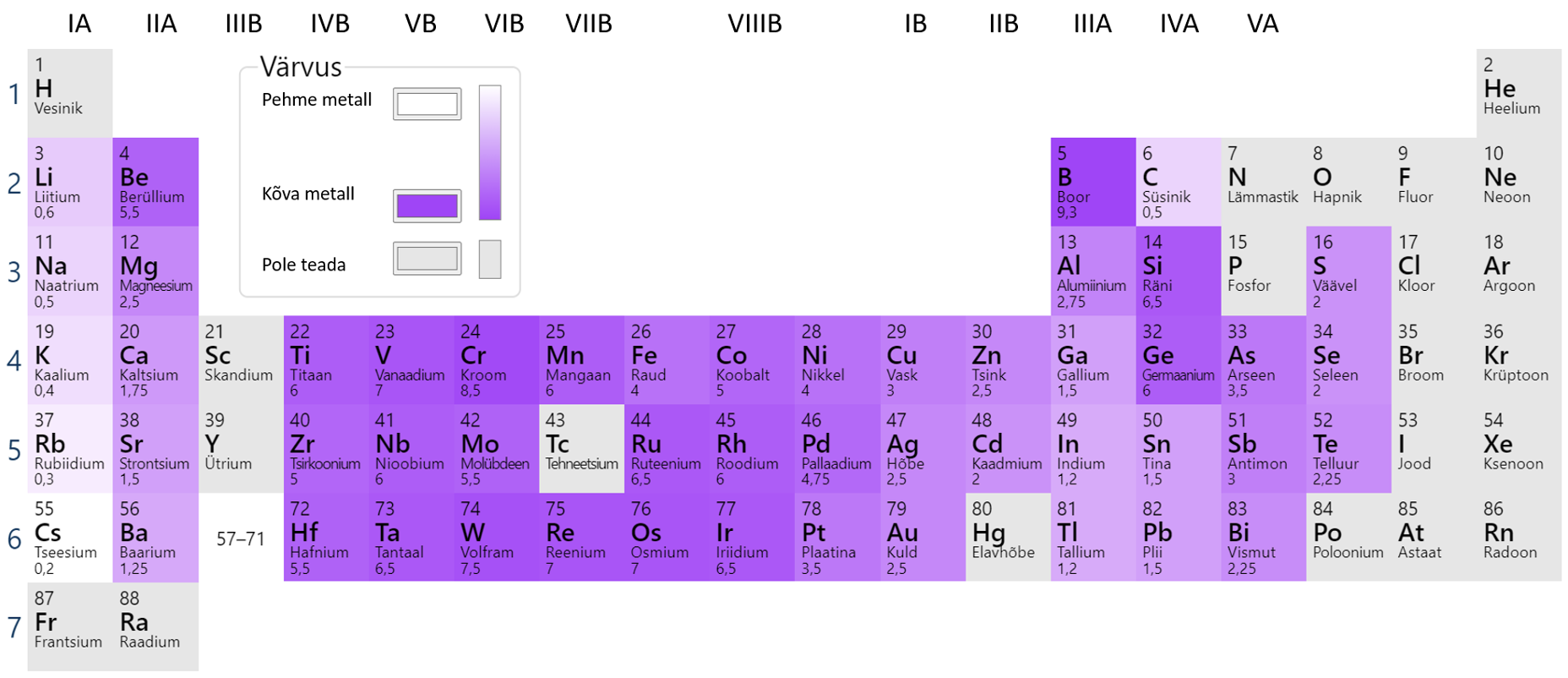
Joonis 6. Metallide kõvaduse võrdlus. Allikas: https://ptable.com/?lang=et#Properties/Hardness/Mohs
 Loe lisaks: Kuidas määrata metallide tugevust.
Loe lisaks: Kuidas määrata metallide tugevust.
Metallide kõvadust määratakse erinevate skaalade alusel, tuntum neist on Mohsi skaala (tabel 2). Skaala aluseks on 10 erinevat mineraali (ainet), millega metalli pindasid kriimustatakse. Selle skaala alusel on kõige tugevam aine teemant, süsiniku üks allotroopidest.
Tabel 2. Mohsi skaala
Metallide sulamistemperatuur
Sulamistemperatuur sõltub metallilise sideme osatähtsusest metallis. Metalliline side on üsna nõrk side. Metallilise sideme osakaal on kõige suurem leelis- ja leelismuldmetallidel, seetõttu on neil ka üsna madal sulamistemperatuur. Perioodilisuse süsteemis rühmas ülevalt alla sulamistemperatuur A rühma metallidel üldiselt kahaneb. See on tingitud sellest, et aatomiraadius suureneb ja metalliline side järjest nõrgeneb (joonis 7).

Joonis 7. Metallide sulamistemeratuuride võrdlus. Allikas: https://ptable.com/?lang=et#Properties/BoilingPoint
Mõnede metallide sulamistemperatuurid on toodud tabelis 1. Madalaima sulamistemperatuuriga on elavhõbe (Hg) ning kõrgeim sulamistemperatuur (3380 °C) on volframil (W). Volframil on aatomitevaheliste kovalentsete sidemete osatähtsus kõige suurem. Väga kõrge sulamistemperatuuriga on ka volframi lähedal asuv tantaal, niibium ja mitmed teised siirdemetallid. Sulamistemperatuuri alusel jaotatakse metallid kerg- ja rasksulavateks. Kergsulavad on metallid, mille sulamistemperatuur on alla 500 °C, ja rasksulavateks nimetatakse metalle, mille sulamistemperatuur ületab 1000 °C.
- Temperatuuril 100–300 °C sulavad: In, Li, Sn.
- Temperatuuril 300–500 °C sulavad: Cd, Pb, Zn.
- Rasksulavad: Cr, Mn, Ni, Fe, Mo, Ta.
- Väga raskesti sulavad: Os, Re, W.
Metallide tihedus
Metallide tihedus on tingitud eelkõige elemendi aatommassist, kristallvõre ehitusest ja vähesemal määral ka aatomiraadiusest. Metalli tihedus on seda väiksem, mida väiksem on selle aatommass ja suurem aatomiraadius. Perioodilisuse tabeli ridades ülevalt alla aatommass suureneb ja seetõttu ka tihedus suureneb. Eriti suure tihedusega on siirdemetallid (joonis 8).
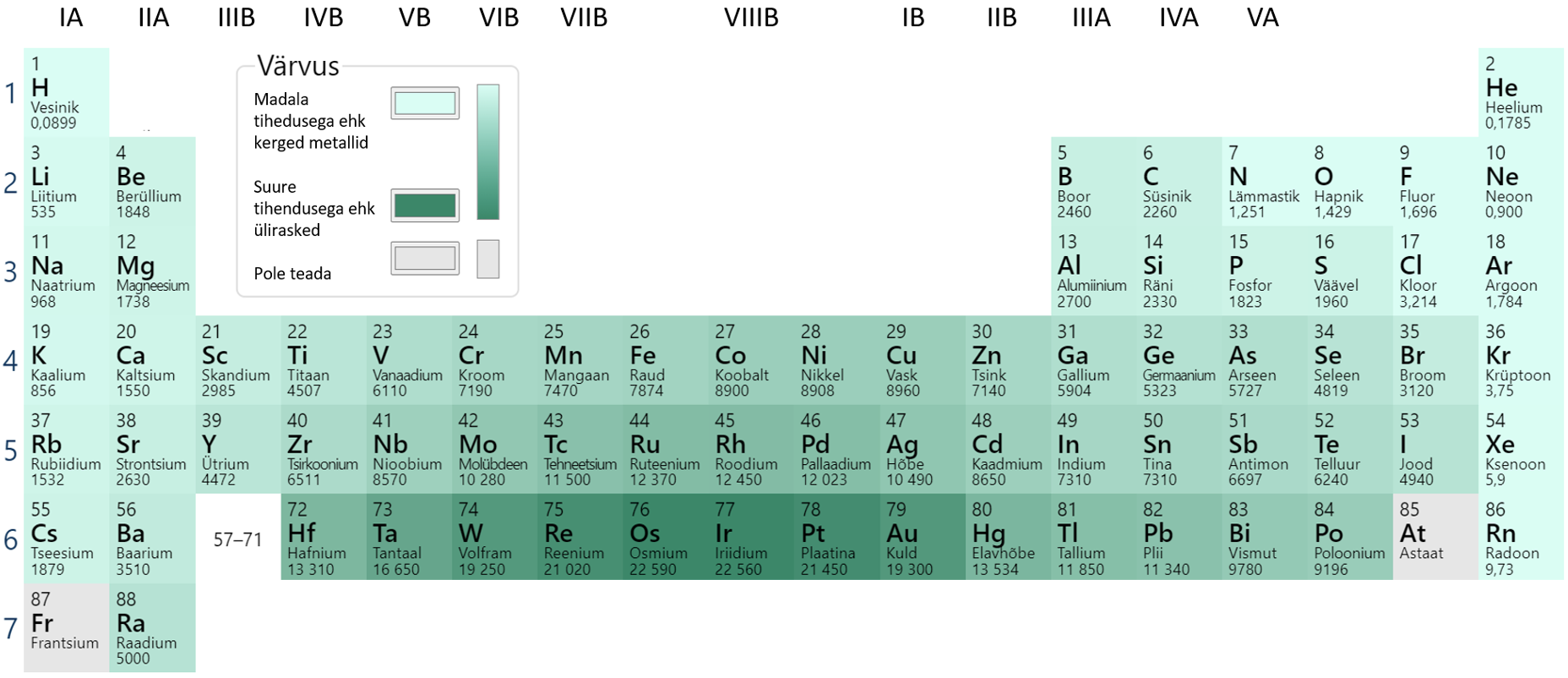
Joonis 8. Metallide tiheduste võrdlus. Allikas: https://ptable.com/?lang=et#Properties/Density/STP
Enamik metalle on veest raskemad, st nende tihedus on suurem kui 1 g/cm3. Eradiks on ainult osa leelismetalle (Na, Li, K). Kergeim metall on liitium. Liitium on isegi nii kerge, et ujub petrooleumi peal (vaata joonis 9).

Joonis 9. Liitium õlis. Allikas: https://en.wikipedia.org/wiki/Lithium#/media/File:Lithium_element.jpg
Tiheduse alusel jaotatakse metallid ja ka sulamid kergmetallideks (kergsulamid, tihedusega alla 5 g/cm3), raskmetallid (rasksulamid, tihedus vahemikus 5–10 g/cm3) ja ülirasketeks (tihedus üle 10 g/cm3). Enamik tuntud argielu metalle on raskmetallid ja nende tihedus on suurem kui 5 g/cm3. Suurima tihedusega on osmium (Os). Praktikas eelistatakse metalle, mis on kerged ehk väikse tihedusega, näiteks alumiinium ja magneesium.
Metallide ja metallisulamite üheks suurimaks eeliseks teiste materjalide ees on plastilisus. Hea plastilisuse annab suur metallilise sideme osakaal. Metallilise sideme osakaal suureneb perioodilisuse tabelis rühmas ülalt alla ja perioodis paremalt vasakule. See omadus teeb metallid ja nende sulamid hästi töödeldavaks, võimaldades neid venitada, valtsida ning sepistada. Kõige pehmemad metallid on leelismetallid, mida saab ka noaga lõigata. Leelismetallid erinevad teistest metallidest ka aktiivuse poolest. Õhuhapniku juuresolekul reageerivad kergesti, mistõttu neid hoitakse sellistes orgaanilistes lahustes, mis takistavad metalli korrosiooni. Leelismetallid ja leelismuldmetallid on tööstuses kasutamiseks liiga pehmed ja keemiliselt aktiivsed.
Füüsikaliste omaduste alusel metallide liigituse võtab kokku joonis 10.