3.3. Keemiline tasakaal ja selle nihkumine
Millal saabub tasakaal?
Eelmises osas nägime, et pöörduvad reaktsioonid võivad kulgeda mõlemas suunas. Võtame seekord vaatluse alla ühe hüpoteetilise reaktsiooni A+B  C+D.
C+D.
Kui lähteained A ja B segada, siis hakkab reaktsioon toimuma kiirusega votse. Koolis sa reaktsiooni kiiruse võrrandit ei õpi, aga selguse mõttes toome selle siin ära. Reaktsiooni kiirust saab arvutada järgmise võrrandi abil:
votse = kotse × [A] × [B]
kus [A] ja [B] on lähteainete kontsentratsioonid ja kotse on otsereaktsiooni kiiruskonstant. Kuna lähteainete kontsentratsioonid reaktsiooni käigus vähenevad, siis peab järelikult vähenema ka otsereaktsiooni kiirus.
Reaktsioon on tasakaaluolekus siis, kui otse- ja pöördreaktsiooni kiirused on võrdsed.
votse = vpöörd
Kuna saadusi tekib järjest juurde, siis hakkab toimuma ka pöördreaktsioon kiirusega vpöörd. Pöördreaktsiooni kiiruse saame avaldada:
vpöörd = kpöörd × [C] × [D]
Pöördreaktsioon on alguses aeglane, sest saadusi on vähe, kuid aja jooksul pöördreaktsiooni kiirus järjest kasvab, kuni saab võrdseks otsereaktsiooni kiirusega:
votse = vpöörd
ning reaktsioon on saavutanud tasakaaluoleku.
Kui tasakaal on saabunud, kas siis reaktsioon enam ei toimu?
Kui tasakaaluolek on saabunud, siis lähteainete ja saaduste kontsentratsioonid enam ei muutu. Äsja kirjutasime võrduse juhuks, kui otse- ja pöördreaktsiooni kiirused on võrdsed. Kuna need kiirused kumbki ei ole nullid, siis peavad reaktsioonid mõlemas suunas edasi toimuma. Sellist nähtust nimetatakse dünaamiliseks tasakaaluks.
Kas tasakaaluolekut saab millegagi mõjutada?
Nüüd vaatame, kuidas reaktsiooni tasakaalu mõjutada, näiteks saada tasakaalulisest reaktsioonist rohkem saadusi.
Allikas: https://youtu.be/RqpanAUUDNw
Kontsentratsiooni mõju
Kui lisada lähteaineid, siis nihkub tasakaal saaduste suunas, sest tasakaalukonstant ei muutu.
Vaatame üldist reaktsiooni A+B  C+D.
C+D.
Kui tasakaalulisele süsteemile lisada ühte (või mõlemat) lähteainet (A-d ja või B-d), siis otsesuunalise reaktsiooni kiirus kasvab ning süsteem ei ole enam tasakaaluolekus. Reaktsiooni käigus hakkavad [A] ja [B] vähenema ja [C] ning [D] suurenema: reaktsioon toimub pärisuunas edasi, kuni saabub taas tasakaal ehk otse ja pöördprotsessi kiirused võrdsustuvad.
Rõhu mõju
Kui rõhku suurendada, siis nihkub reaktsioon selles suunas, kus on vähem gaasimolekule.
Rõhu muutus mõjutab selliseid reaktsioone, milles gaasi moolide arv muutub. Kui reaktsioonisegu N2O4  2NO2 rõhku suurendada, siis nihkub tasakaal N2O4 tekke suunas, mille tulemusena hakkab gaasisegu rõhk vähenema, sest reaktsioonivõrrandi vasakul pool on vähem gaasimolekule.
2NO2 rõhku suurendada, siis nihkub tasakaal N2O4 tekke suunas, mille tulemusena hakkab gaasisegu rõhk vähenema, sest reaktsioonivõrrandi vasakul pool on vähem gaasimolekule.
Temperatuuri mõju
Temperatuuri mõju hindamiseks vaata allolevat joonist ja püüa selgitada, kas reaktsioon N2O4  2NO2 on endo- või eksotermiline? Vasakul on ampull gaasiseguga paigutatud jäässe, keskel on jää ja vee segus (st null kraadi juures) ja paremal on ampull toatemperatuuril.
2NO2 on endo- või eksotermiline? Vasakul on ampull gaasiseguga paigutatud jäässe, keskel on jää ja vee segus (st null kraadi juures) ja paremal on ampull toatemperatuuril.
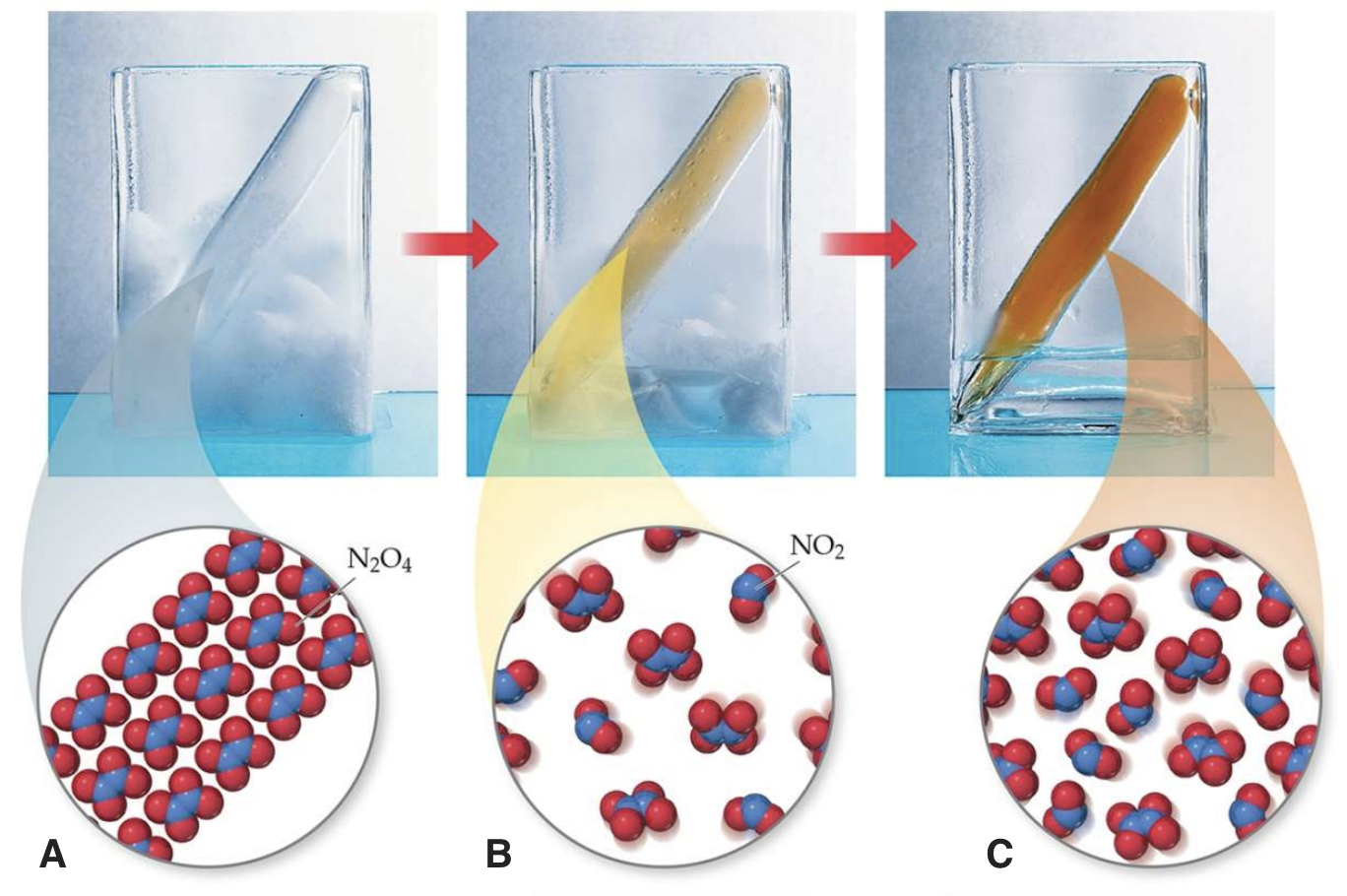
Joonis 1. N2O4 ⇄ 2NO2 reaktsioon erinevatel temperatuuridel. A) reaktsioonisegu on asetatud jäässe, B) reaktsioonisegu on 0 oC juures, C) reaktsioonisegu on toatemperatuuril. Allikas: https://www.unf.edu/~michael.lufaso/chem2046/2046chapter15.pdf
Endotermilise reaktsiooni tasakaalukonstant suureneb, kui temperatuuri tõsta.
Kui temperatuuri tõsta, siis reaktsiooni tasakaal nihkub paremale ehk saaduste suunas. Järelikult on see reaktsioon endotermiline.
Võib-olla on temperatuuri mõjust kergem aru saada, kui reaktsioon kirjutada tavapärasest veidi erinevalt, arvestades, et endotermiline reaktsioon tarbib soojust:
N2O4 + soojus  2NO2
2NO2
Le Chatelier' printsiip: kui mingi välismõju (temperatuuri, kontsentratsiooni või rõhu muutmine) rikub keemilist tasakaalu, siis kulgeb selle mõju tagajärgi vähendav reaktsioon, mis viib süsteemi üle uude tasakaaluolekusse.
Kui temperatuuri tõstame, siis lisame reaktsioonisegusse soojust juurde ja endotermiline reaktsioon nihkub saaduse suunas ehk NO2 tekke suunas.
Tavaliselt lisatakse vajadusel viide soojusefektile selliselt:
N2O4  2NO2 ΔH > 0
2NO2 ΔH > 0
Eksotermilises reaktsioonis soojus eraldub (soojus on saaduste hulgas). Kui tõsta temperatuuri, siis nihkub tasakaal lähteaine tekke suunas.
Kõik need nähtused võtab kokku Le Chatelier' printsiip: Kui mingi välismõju (temperatuuri, kontsentratsiooni või rõhu muutmine) rikub keemilist tasakaalu, siis kulgeb selle mõju tagajärgi vähendav reaktsioon, mis viib süsteemi üle uude tasakaaluolekusse.
Kas katalüsaator mõjutab tasakaalu?
Katalüsaator kiirendab reaktsiooni, kuid ei muuda reaktsiooni tasakaaluolekut.
Katalüsaatori manulusel toimub reaktsioon sellist teed pidi, kus reaktsiooni aktivatsioonienergia on madalam. Reaktsioon saavutab tasakaaluoleku kiiremini, kuid alaneb nii otse- kui ka pöördreaktsiooni aktivatsioonienergia barjäär ning tasakaal ei muutu.

